Trafic vésiculaire :
Endocytose clathrine-indépendante (CIE)
Cavéoles
Cavéolines
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires : trafic vésiculaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Les cavéolines sont une famille de protéines membranaires intégrales qui font partie des protéines d'échafaudage (scaffold) dans les membranes cavéolaires.
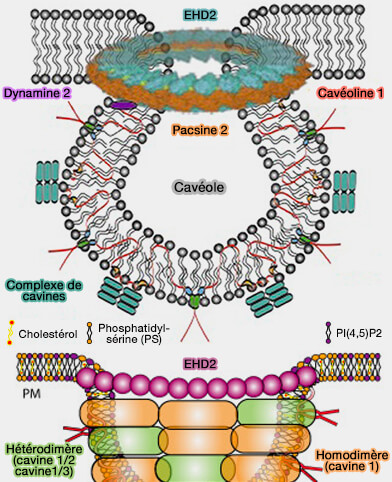
(Figure : vetopsy.fr d'après Lian et coll et Parton et coll)
1. La formation de la fosse cavéolaire implique l'action coordonnée de plusieurs protéines (Caveolae 2018).
a. Les protéines membranaires intégrales, i.e. les cavéolines (CAV), sont essentielles à leur formation, i.e. leur KO inhibe la genèse cavéolaire.
b. Les protéines de la membrane périphérique, i.e. les cavines, interagissent avec les cavéolines pour former un complexe de revêtement externe qui remodèle la membrane plasmique (MP) en cavéoles et les stabilisent par leurs interactions avec les lipides membranaires, i.e. cholestérol, phosphatidylsérine (PS) et PI(4,5)P2 ou PIP2.
c. Les complexes protéiques au niveau du cou impliquent :
- des protéines EHD comme EHD2 (Eps-15 Homology Domain 2), une ATPase formant un anneau autour du cou cavéolaire,
- les syndapines/PACSINes, i.e. syndapine 2/3 des protéines à domaine F-BAR, interviendraient (parfois ou toujours ?) pour remodeler la membrane.
Remarque : des protéines transmembranaires comme ROR1 (Receptor tyrosine kinase-like Orphan Receptor 1), qui interagit avec CAV1 et la cavine 1, pourraient faciliter la formation de cavéoles, mais pas dans tous les tissus.
2. La composition lipidique de nanodomaines membranaires, en particulier, cholestérol et en phospholipides chargés négativement, i.e. phosphatidylsérine (PS) et PI(4,5)P2 ou PIP2, est indispensable à la biogenèse des cavéoles.
L'assemblage ainsi que les interactions entre toutes ces molécules, i.e. protéines/lipides, protéines/protéines et lipides/lipides sont loin d'être connus, ce qui implique que certains articles un peu anciens ne sont plus d'actualité et que les modèles sont nombreux.
Vue d'ensemble des cavéolines
Cavéolines cavéolaires
1. Les cavéolines sont une famille de protéines membranaires intégrales qui font partie des protéines d'échafaudage (scaffold) dans les membranes cavéolaires.
- Elles compartimentent et concentrent les molécules de signalisation, i.e. les sous-unités des protéines G, les tyrosine kinases réceptrices et non réceptrices, l'oxyde nitrique synthase endothéliale (eNOS) et les petites GTPases.
- Lorsqu'elle est exprimée seule dans des cellules de mammifères, CAV1, localisée de manière diffuse dans la membrane plasmique, est incapable de former des cavéoles sphériques en l'absence de cavines (
biogenèse des cavéoles).
Remarque : CAV1 est capable de générer des vésicules membranaires similaires aux cavéoles (h-cavéoles) chez Escherichia coli, i.e. Cav1 a une capacité intrinsèque de générer une courbure membranaire, activée semble-t-il, par la composition lipidique spécifique des membranes d'E. coli (
(Figure : vetopsy.fr d'après Pradhan et coll)
2. Les Cavs sont les principaux composants protéiques des cavéoles, influençant la composition de la membrane et la teneur en protéines de la traduction à la dégradation, i.e., la traduction et l'oligomérisation précoce des Cavs commencent la voie de biogenèse des cavéoles (
Cavéolines non cavéolaires
1. Toutefois, les cavéolines, dans les hépatocytes, dans de nombreux neurones, les lymphocytes, les cils et les cellules cancéreuses, sont exprimées sans former de cavéoles (Non-caveolar caveolins – duties outside the caves 2020 pour une revue).
- D'une part, la capacité des cavéolines d'organiser et de sculpter les membranes ainsi que leur trafic intracellulaire complexe peuvent contribuer à ces rôles supplémentaires.
- D'autre part, les cavéolines non cavéolaires peuvent potentiellement interagir avec des protéines exclues des cavéoles.
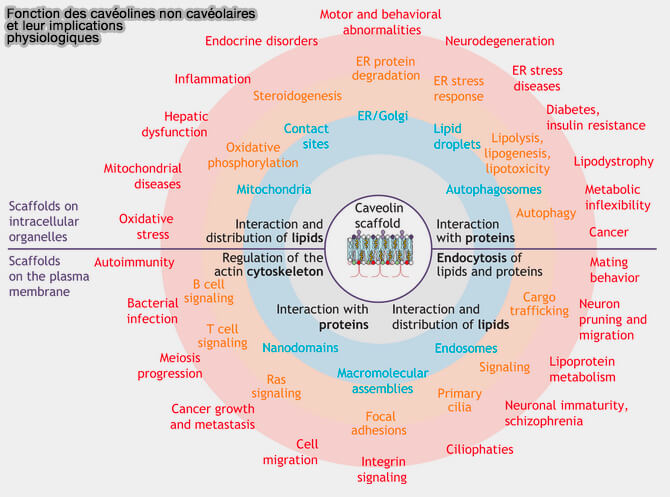
(Figure : vetopsy.fr d'après Pol et coll)
2. Par le biais du contrôle des flux intracellulaires de cholestérol et des lipides membranaires, les cavéolines contrôlent directement ou à distance une pléthore de processus lipido-dépendants tels que l'endocytose de cargaisons spécifiques, le tri et le transport dans des compartiments endocytaires, ou différentes voies de signalisation qui interviennet dans d'autres mécanismes comme :
- les adhésions focales,
- l'autophagie via la régulation de la fonction lysosomale et la fusion autophagosomes/lysosomes (Critical role of CAV1/caveolin-1 in cell stress responses in human breast cancer cells via modulation of lysosomal function and autophagy 2015).
Structure des cavéolines
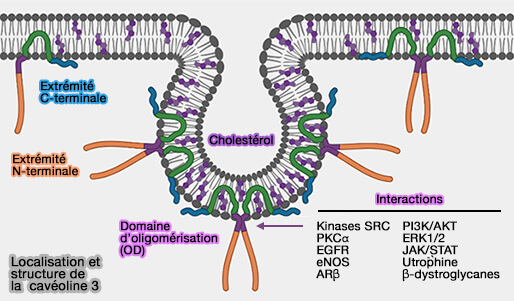
1. La famille de la cavéoline comprend trois membres chez les vertébrés.
- La cavéoline-1 (Cav1) est principalement exprimée dans les tissus endothéliaux, fibreux et adipeux et se présente sous deux isoformes, la cavéoline-1α et la cavéoline-1β qui, elle, semble dépourvue d'une partie de l'extrémité N-terminale.
- La cavéoline-2 (Cav2) semble co-exprimée avec la cavéoline-1 et se retrouve donc dans les mêmes tissus, mais ne semble pas essentielle à la formation cavéolaire.
- La cavéoline-3 (Cav3) se trouve dans les muscles striés et lisses et ses mutations sont responsables de dystrophies musculaires ( A Role for Caveolin-3 in the Pathogenesis of Muscular Dystrophies 2020).
(Figure : vetopsy.fr d'après Porta et coll)
2. Les trois cavéolines ont une structure identique, forment des oligomères et s'associent au cholestérol et aux sphingolipides dans certaines zones de la membrane cellulaire, pour former des cavéoles.

Une description détaillée est consultable dans : Molecular architecture of the human caveolin-1 complex (2022), article qui forme l'essentiel de la trame de ce chapitre, mais aussi dans Cell-free formation and interactome analysis of caveolae (2018), article dans lequel on trouve une liste non exhaustive des partenaires de CAV1.
Remarque 1 : bien que les protéines de cavéoline se trouvent exclusivement chez les métazoaires (Evolutionary analysis and molecular dissection of caveola biogenesis 2008), lorsqu'elles sont exprimées chez Escherichia coli, i.e. h-cavéole, elles forment des complexes de type 8S qui possèdent deux fonctions essentielles dans les cellules de mammifères (Structure and assembly of CAV1 8S complexes revealed by single particle electron microscopy 2020).
- Elles induisent la formation de cavéoles hétérologues ou h-cavéoles par oligomérisation (Molecular Characterization of Caveolin-induced Membrane Curvature 2015).
- Elles changent la courbure des membranes.
Remarque 2 : Chez les organismes supérieurs, l'intervention des cavines est indispensable à cette courbure membranaire (
Dans les cellules de mammifères, Cav1 seule peut former des structures membranaires tubulaires (Caveolin-1 Induces Formation of Membrane Tubules That Sense Actomyosin Tension and Are Inhibited by Polymerase I and Transcript Release Factor/Cavin-1 2010).
Structure générale
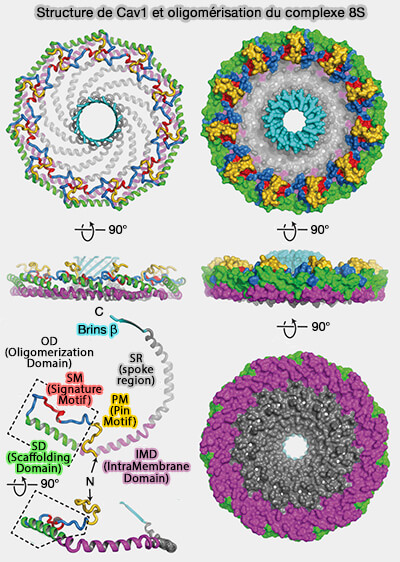
1. Les cavéolines-1 (Cav1) s'organisent en un complexe en forme de disque formé de 11 protomères d'un diamètre d'environ 140 Å et d'une hauteur d'environ 34 Å qui comporte :
- un " rebord " extérieur de 23 Å de large,
- un " moyeu " central, tonneau β de 28 Å de large,
- 11 " rayons " α-hélicoïdaux incurvés.
La face plane du complexe correspond à la surface faisant face à la membrane, alors que le tonneau β fait face au cytoplasme et que la cavité centrale du barillet s'étend entièrement à travers le complexe et est ouverte au solvant du côté faisant face au cytoplasme.
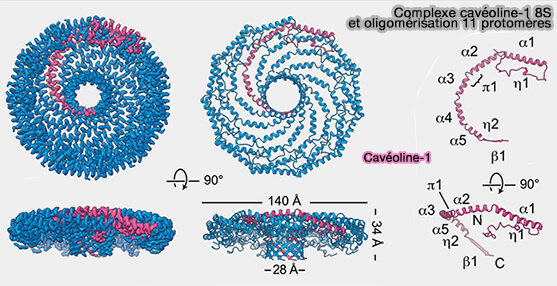
(Figure : vetopsy.fr d'après Mahmutefendic et coll)
2. La structure de Cav1 comprend plusieurs régions.
a. L'extrémité N-terminale non hélicoïdale, intracytoplasmique, qui fait partie de la région du rebord, consiste en une boucle avec une courte hélice 310 (η1).
Cette région fait un virage à 180° au bord extérieur du complexe, s'intercalant avec les rayons et les régions N-terminales des protomères voisins.
b. Une région α-hélicoïdale est formée par α1 à α5.
Vues de côté, les hélices α2 à α5 du protomère s'alignent le long de la surface plane du complexe, et l'hélice 1 forme un angle d'environ 20° avec cette surface.
c. L'extrémité C-terminale, intracytoplasmique, se termine par un brin β incliné d'environ 40 ° par rapport au plan de la surface plane du disque.
Ces brins β interagissent pour former un moyeu cylindrique β parallèle à 11 brins.
Structure fine
La cavéoline-1 est composée de plusieurs domaines.
1. La région N-terminale (résidus 1-48), désordonnée, est indispensable à la formation des cavéoles et semble intervenir dans des interactions faibles avec les cavines (
2. La région suivante (résidus 49-60), appelée PM ou " Pin Motif " (pin, en français broche, épingle, punaise), car elle semble " verrouiller " l'interaction entre les protomères qui est nécessaire à l'assemblage des cavéoles et à la localisation dans les fibroblastes en migration (Identification of a Novel Domain at the N Terminus of Caveolin-1 That Controls Rear Polarization of the Protein and Caveolae Formation 2007).
Remarque : ces deux régions peuvent être groupées dans la région désordonnée N-terminale, i.e. la région de Cav1 (30-60) intervient entre autres dans les interactions floues (fuzzy) avec le domaine DR3 de la cavine 1 (310-331).
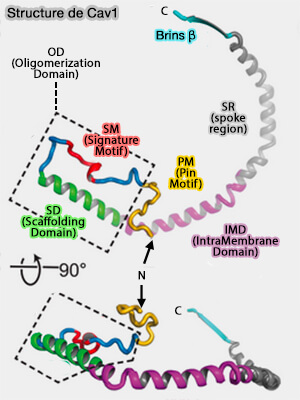
(Figure : vetopsy.fr d'après Porta et coll)
3. L'OD (Oligomerization Domain), i.e. résidus 61 à 101, situé sur le rebord extérieur du disque et contribuant aux interfaces étendues des sous-unités, comprend deux sous-domaines.
a. Le SM (Signature Motif), i.e. résidus 68 à 75, est en contact étroit avec deux protomères voisins.
b. Le SD (Scaffolding Domain ou CSD, i.e. résidus 82 à 101, comprend la majeure partie de l'hélice α1 et entoure la périphérie du complexe.
- Les résidus 94 à 101 formeraient un motif CRAC (Cholesterol-Recognition Amino acid Consensus) ou (L/V)-x1–5-(Y)-x1–5-(K/R) de liaison au cholestérol, i.e. ici VTKYWFYR (Structural Characterization of the Caveolin Scaffolding Domain in Association with Cholesterol-Rich Membranes 2012).
- Son rôle dans l'architecture du complexe est encore inconnu.
Les cavéolines pourraient regrouper d'autres lipides comme la phosphatidylsérine (PS).
La déplétion des cavéoles par knockdown de CAV1 entraîne une réorganisation des domaines PS au sein de la membrane plasmique (Caveolae regulate the nanoscale organization of the plasma membrane to remotely control Ras signaling 2014).
c. Les résidus séparant le SM et le SD effectuent deux virages à 90°, rapprochant ces deux motifs.
4. L'IMD (IntraMembrane Domain), i.e. résidus 102 à 134, commence à l'extrémité C-terminale de l'hélice α1 immédiatement adjacente à la SD et se continue par l'hélice α2 et une partie de α3.
5. La SR (spoke region), i.e. résidus 135 à 169, est nécessaire à la formation des cavéoles, à l'oligomérisation et à la sortie de la protéine de l'appareil de Golgi : elle forme des rayons organisés parallèlement au plan membranaire.
- Ces résidus forment la surface hydrophobe plane du complexe faisant face à la membrane tout en créant une surface fortement chargée négativement faisant face au cytoplasme.
- L'hélice α5 (résidus 143 à 155) déforme cette surface plane en se pliant vers le côté du complexe faisant face au cytoplasme où elle se connecte à un brin β (résidus 170 à 176).
6. La région C-terminale à partir du résidu 170, formée des brins β des protomères adjacents, s'assemble pour former un tonneau β parallèle à 11 brins avec un extérieur hydrophile et un intérieur hydrophobe.
- Cette structure, le plus grand baril β parallèle connu à ce jour, est coiffée par Lys176, introduisant une couche hautement chargée positivement séparant l'intérieur hydrophobe du baril du cytoplasme.
- La région accessible la plus étroite de l'intérieur du barillet β a un diamètre de 15 Å, ce qui rend le canal suffisamment grand pour accueillir de petites molécules telles que des lipides.
Remarque : dans la figure ci-dessous, la structure primaire est exacte, mais les domaines ne correspondent pas exactement à ceux décrits ci-dessus (Caveolins and cavins in the trafficking, maturation, and degradation of caveolae: implications for cell physiology 2017).
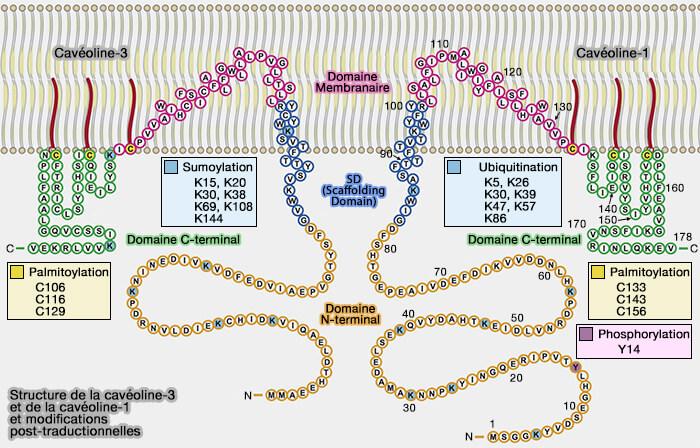
(Figure : vetopsy.fr d'après Busija et coll)
Oligomérisation des cavéolines
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


