Trafic vésiculaire
Endocytose clathrine-indépendante (CIE)
Endocytose CLIC/GEEC
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires : trafic vésiculaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

La voie CLIC/GEEC est une voie d'endocytose clathrine-indépendante (CIE) caractérisée par des protrusions membranaires en forme de tubules, et non en forme de vésicules comme dans les autres CIE.
En règle générale, on peut diviser les endocytoses en (
- CME (Clathrin-Mediated Endocytosis) ou endocytose clathrine-dépendante,
- CIE (Clathrin-independant Endocytosis) qui comprend toutes les autres endocytoses.
En outre, on peut les diviser selon qu'elles utilisent ou pas la dynamine pour le détachement membranaire de la vésicule.
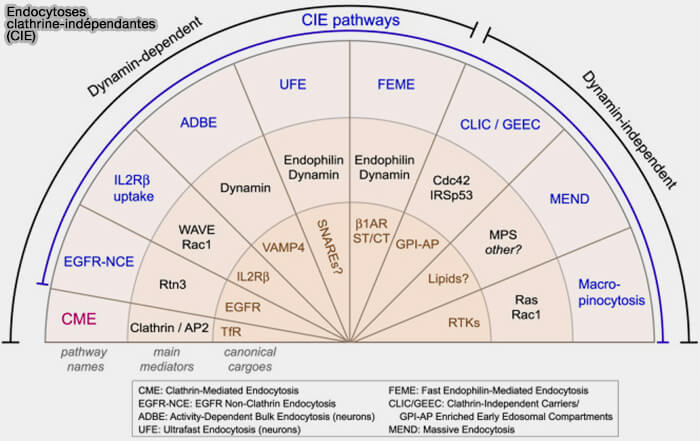
(Figure : vetopsy.fr d'après Casamento et Boucrot)
Modèle GL-Lect de certaines CIE
Certaines modalités de l'endocytose clathrine-indépendante (CIE) reposent sur le regroupement du cargo à la surface cellulaire par des lectines (Lect), en sus des protéines d'échafaudage intracellulaire.

Dans ce cas, la construction du puits endocytaire est favorisée par la courbure de la membrane, i.e. un signal mécanique, plutôt que par la stimulation par un ligand, i.e. un signal biochimique.
1. Les CIE dépendantes de la lectine ont toutes un mécanisme commun :
- regroupement des glycosphingolipides par les lectines, et parfois des protéines glycosylées comme les galectines, à la surface cellulaire,
- induction d'un stress asymétrique membranaire avec formation locale de courbure,
- libération de cette contrainte par tubulation spontanée de la membrane vers l'intérieur de la cellule.
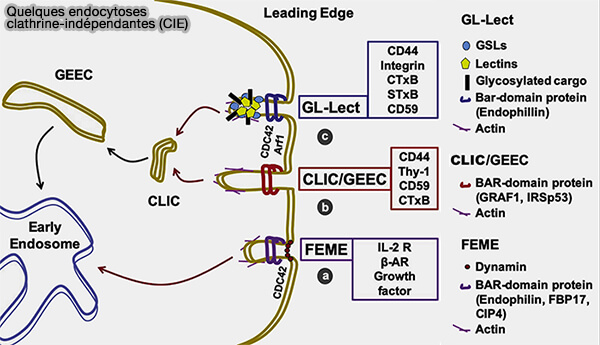
(Figure : vetopsy.fr d'après Shafaq-Zadah et coll)
2. Les glycolipides (GL) et les lectines (Lect) coopéreraient pour entraîner la formation de noyaux endocytaires tubulaires sans l'aide, semble-t-il, de manteaux cytosoliques (GL-Lect Endocytosis in In-Vivo Model Systems 2019).
Remarque : selon cette hypothèse, un transport rétrograde des cargos les conduit vers l'appareil de Golgi périnucléaire pour leur redistribution par sécrétion polarisée (Clathrin-independent endocytosis, retrograde trafficking, and cell polarity 2020).

Vous pouvez lire : GL-Lect endocytosis in in-vivo model systems (2019).
Voie CLIC/GEEC (CG)
La voie CLIC/GEEC est nommée ainsi en raison du fait que les cargos :
- sont internalisés par cette voie CLIC (CLathrin-Independent Carrier),
- se retrouvent dans un premier temps dans un compartiment distinct de l’endosome précoce appelé GPI Enriched Early Compartment (GEEC).
1. La voie CLIC-GEEC (CG) est impliquée dans l’endocytose :
- des protéines à ancre GPI (GPI-AP), i.e. CD59, CD55 (facteur accélérant le déclin), récepteur de folates (FOLR) ou CD90/Thy-1,
Les glycosylphosphatidylinositols (GPI) sont des glycophospholipides complexes des eucaryotes qui ancrent, par leurs extrémités C-terminales, des protéines cellulaires au feuillet externe de la membrane plasmique.
- des protéines transmembranaires glycosylées, i.e. CD44 et CD98,
- des lectines extracellulaires, i.e. galectine-3 ou CTxB.
(Figure : vetopsy.fr d'après Howes et coll)
2. La voie CG est impliquée dans l’endocytose d’une partie de la phase fluide, de manière distincte de la macropinocytose, puisqu'elle est insensible à l’amiloride, un inhibiteur spécifique de la macropinocytose (Clathrin-independent carriers form a high capacity endocytic sorting system at the leading edge of migrating cells 2010).
3. La nature constitutive de la voie CG, sa cinétique ainsi que le fait qu’elle prenne en charge de grands volumes de membrane en font un bon candidat pour contribuer significativement au renouvellement de la membrane plasmique, afin de réguler la surface cellulaire et, de ce fait, la tension membranaire (Clathrin-Independent Pathways of Endocytosis 2014).
Le recyclage de compartiments GEEC vers la membrane plasmique est stimulé lorsque la tension membranaire est augmentée (Plasma Membrane Area Increases with Spread Area by Exocytosis of a GPI-anchored Protein Compartment 2009).
Mécanisme de la voie CG
La voie CG utilise la polymérisation de l'actine (Nanoclusters of GPI-Anchored Proteins Are Formed by Cortical Actin-Driven Activity 2008).
- Le cholestérol est particulièrement important pour le regroupement des protéines à ancre GPI (Cholesterol-Sensitive Cdc42 Activation Regulates Actin Polymerization for Endocytosis via the GEEC Pathway 2007).
- Le mécanisme d’enrichissement des CLIC en GPI-AP dépend de phénomènes d’encombrement stérique des protéines et de l’affinité des ancres GPI pour les microdomaines riches en cholestérol (Steric and not structure-specific factors dictate the endocytic mechanism of glycosylphosphatidylinositol-anchored proteins 2009).
L’actine et ses régulateurs jouent un rôle crucial dans cette voie d’endocytose.
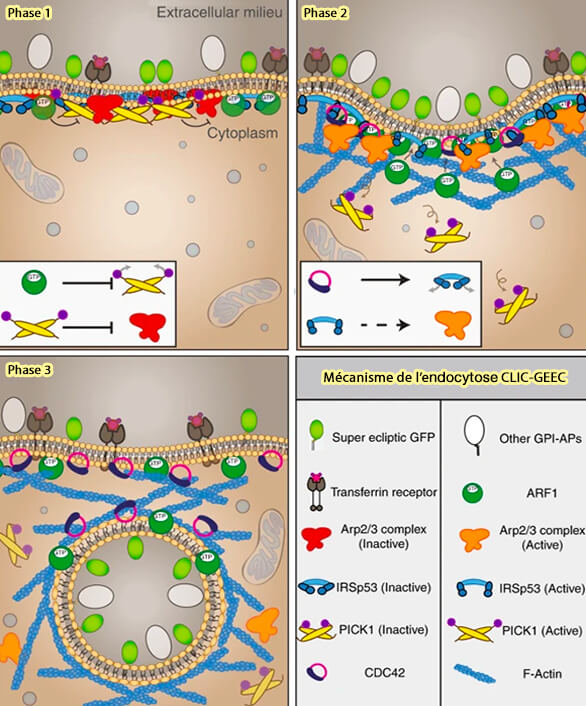
Phase 1 : GBF1, Arf1, Pick1, ARP2/3 et IRSP53
1. La machinerie moléculaire de la voie CG est initiée par le recrutement de GBF1 (Golgi-specific brefeldin A-resistance guanine nucleotide exchange factor 1), un GEF (Guanine nucleotide exchange factor) qui permet l’activation de la petite GTPase Arf1 ou ADP ribsolation factor 1 ( Analysis of Endocytic Pathways in Drosophila Cells Reveals a Conserved Role for GBF1 in Internalization via GEECs 2009).
(Figure : vetopsy.fr d'après Kast et coll)
Arf1 recrute ARHGAP10 à la surface membranaire (ARF1 is directly involved in dynamin-independent endocytosis 2008).
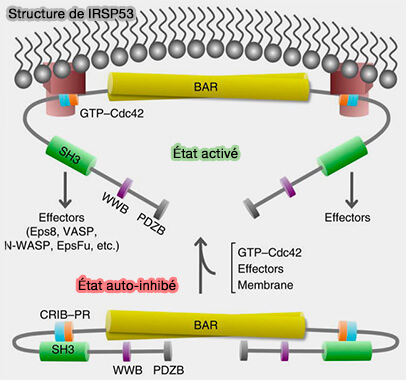
2. L'IRSP53 et Pick1 sont importants (Small GTPases and BAR domain proteins regulate branched actin polymerisation for clathrin and dynamin-independent endocytosis 2018).
a. IRSP53 peut être recruté par son domaine I-BAR en l'absence de GTP-CDC42, en gardant son domaine SH3 dans un état inhibé (Activated I-BAR IRSp53 clustering controls the formation of VASP-actin–based membrane protrusions 2022).
L'élimination de l'IRSP53, une protéine de détection de courbure négative, abolit l'endocytose CG.
b. Pick1 est un inhibiteur du complexe Arp2/3, le gardant dans son état inactif.
Phase 2 et 3 : Cdc42 et actine
(Figure : vetopsy.fr d'après Sathe et coll)
1. ARHGAP10 permet alors le maintien de la RhoGTPase Cdc42 sous sa forme active et Cdc42 se lie à IRSP53 pour l'activer.
2. Le domaine SH3 d'IRSP53 peut désormais se lier au complexe Arp2/3, recrutant ainsi la machinerie de polymérisation de l’actine à la membrane plasmique (Cholesterol-Sensitive Cdc42 Activation Regulates Actin Polymerization for Endocytosis via the GEEC Pathway 2007).
(Figure : vetopsy.fr d'après Boisvert et coll)
Remarque : la voie CLIC/GEEC est indépendante de la dynamine pour la scission, mais elle se colocalise avec les GEEC et semble nécessaire pour le recyclage à la membrane plasmique.
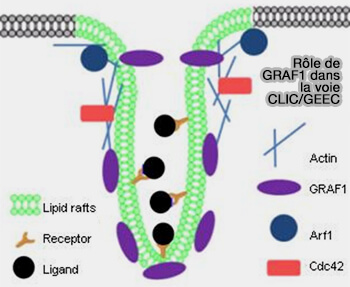
GRAF1
GRAF1, protéine à domaine N-BAR et à domaine SH3, pourrait initier la courbure membranaire des CLIC et la formation du tubule de 40 nm (The GTPase-Activating Protein GRAF1 Regulates the CLIC/GEEC Endocytic Pathway 2008 et Endocytic membrane turnover at the leading edge is driven by a transient interaction between Cdc42 and GRAF1 2015).
Elle a été mise en évidence récemment dans les lymphocytes T (Cdc42 Couples T Cell Receptor Endocytosis to GRAF1-Mediated Tubular Invaginations of the Plasma Membrane 2019).
Galectine
La formation d'invaginations tubulo-vésiculaires CLIC/GEEC de la membrane plasmique est entraînée par les galectines cytoplasmiques, mais aussi extracellulaires.
Les galectines, qui font partie des lectines, forment une famille de 15 protéines spécialisées dans la liaison aux galactosides, mais aussi à d'autres sites non glucides, et sont impliquées dans divers processus physiologiques (Galectins at a glance 2018).
1. La galectine-3 conduit la biogenèse des structures CLIC de manière glycosphingolipide-dépendante (Galectin-3 drives glycosphingolipid-dependent biogenesis of clathrin-independent carriers 2014).
Son interaction avec les protéines glycosylées, comme CD44 ou les intégrines β1, et les glycosphingolipides à la surface cellulaire, pourrait permettre son oligomérisation pour regrouper les cargos et les GL et ainsi déformer la membrane plasmique pour former des tubules.
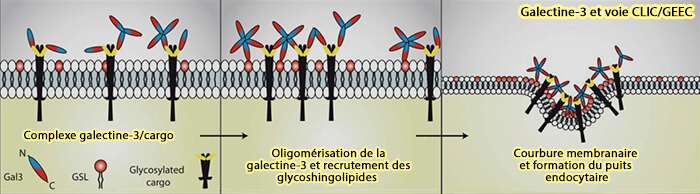
(Figure : vetopsy.fr d'après Lakshminarayan et coll)
2. La modulation des interactions glycanes ou polyosides/lectines peut affecter le comportement du cargo, i.e. continuum entre stimulation et inhibition de l'absorption (Distinct cargo-specific response landscapes underpin the complex and nuanced role of galectin–glycan interactions in clathrin-independent endocytosis 2018).
Cela peut expliquer les différences observées entre les types de cellules.
3. Des galectines différentes peuvent contribuer à la formation de sous-populations distinctes de CLIC.
La CG conduite par la galectine-3 est à la base de la transcytose (Glycolipid-dependent and lectin-driven transcytosis in mouse enterocytes 2021).
Remarque : l'endocytose impliquant l'endophiline A3 implique une galectine-8 comme dans l'internalisation de CD166/ALCAM (Endophilin-A3 and Galectin-8 control the clathrin-independent endocytosis of CD166 2020).
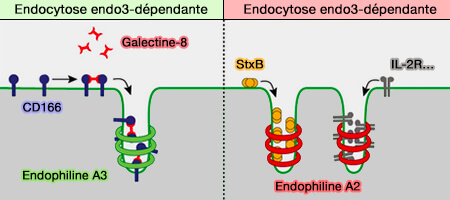
(Figure : vetopsy.fr d'après Renard et coll)
CD166/ALCAM (Activated Leukocyte Cell Adhesion Molecule), protéine transmembranaire immunoglobuline-like impliquée dans les contacts cellule-cellule par des interactions avec son ligand CD6, est présente à la surface des lymphocytes T et d'autres cellules immunitaires.
Adressage des tubules
Les tubules sont ensuite adressés dans les GEEC, dans lesquels les cargos pourront alors être triés vers différents compartiments membranaires comme les lysosomes ou vers un compartiment de recyclage périnucléaire.
La voie CLIC/GEEC est indépendante de la dynamine pour la scission, mais elle se colocalise avec les GEEC et semble nécessaire pour le recyclage à la membrane plasmique.
Remarque : les cavéolines 1 et 3 et les cavines 1 et 3 inhibent l’activité de la voie CG, alors que leur déplétion l’augmente (Endocytic Crosstalk: Cavins, Caveolins, and Caveolae Regulate Clathrin-Independent Endocytosis 2014).
- La cavine 1 non cavéolaire agirait, en outre, comme un régulateur de l’activité de Cdc42.
- La spécificité moléculaire des différentes voies est difficile à définir et les différentes CIE ont la capacité de se compenser.
Retour vers l'endocytose clathrine-indépendante (CIE)
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


