Cycle cellulaire
Reproduction cellulaire
Kinétochore et attachements chromosomiques
Régulation du kinétochore
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

La régulation du kinétochore intègre signaux de phosphorylation, tension mécanique et dynamique microtubulaire pour stabiliser les attachements corrects et autoriser la transition métaphase-anaphase.
La stabilité fonctionnelle du kinétochore dépend d’un ajustement fin entre mécanismes biochimiques et contraintes mécaniques, qui contrôlent l’établissement, la correction et la consolidation des attachements aux microtubules.
Ces régulations conditionnent la capacité du kinétochore à passer d’un état permissif et réversible à un état mécaniquement verrouillé, compatible avec la progression mitotique, sans redéfinir les mécanismes du point de contrôle du fuseau (SAC) qui détectent les kinétochores mal attachés ou non attachés (
Régulation enzymatique
1. Aurora B, kinase du CPC (Chromosomal Passenger Complex), se localise préférentiellement à la région centromérique et à la couche interne du kinétochore.
Lorsque la tension est faible, elle phosphoryle plusieurs composants du kinétochore externe, notamment Ndc80, diminuant l’affinité des complexes d’attachement pour les microtubules et favorisant la correction des attachements incorrects, notamment syntéliques et mérortéliques.
2. Le complexe cycline B/CDK1 (MPF) assure la coordination entre la progression du cycle cellulaire et la maturation progressive des attachements, et participe au contrôle temporel de l’assemblage et de la dynamique du kinétochore en phosphorylant :
- des composants du CCAN (CENP-C, CENP-T),
- le complexe KMN,
- des modules du point de contrôle du fuseau (SAC), i.e. Mad1, BubR1.
3. Les phosphatases PP1 et PP2A-B56 antagonisent l’action des kinases mitotiques au niveau du kinétochore et favorisent :
- la stabilisation des attachements end-on stables,
- la diminution progressive de la signalisation du SAC lorsque la tension bipolaire est établie.
Régulation par la tension exercée sur le kinétochore

La tension exercée sur le kinétochore constitue un signal régulateur central.
Cette tension :
- modifie l’accessibilité des substrats aux enzymes mitotiques, kinases et aux phosphatases,
- favorise le recrutement de complexes associés aux attachements stables.
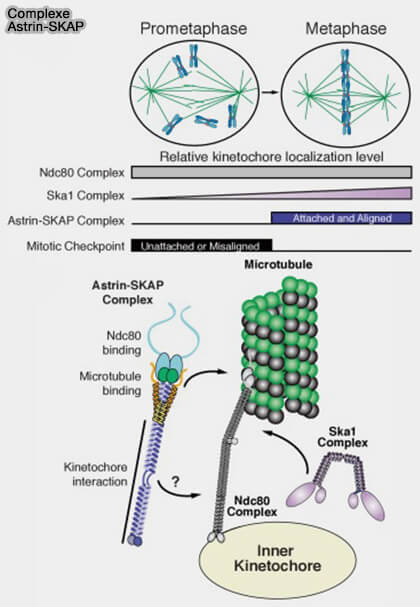
1. Le complexe Astrin-SKAP s’accumule préférentiellement sur les kinétochores correctement attachés et sous tension, où il contribue à la stabilisation des interactions kinétochore-microtubule et à la protection des sites d’attachement contre la phosphorylation par Aurora B en métaphase.
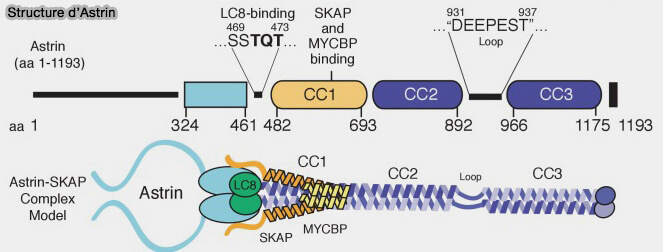
Structure du complexe Astrin-SKAP
Le complexe Astrin-SKAP est composé principalement dr deux éléments (Astrin-SKAP complex reconstitution reveals its kinetochore interaction with microtubule-bound Ndc80 2017).
(Figure : vetopsy.fr d'après kern et coll)
1. Astrin (SPAG5) constitue l’élément structural principal du complexe.
a. Le domaine N-terminal interagit avec SKAP et positionne le complexe le long du microtubule.
b. La région centrale coiled-coil (CC1/2/3) interagit avec SKAP et LC8, conférant une dimérisation et une stabilité intrinsèque du complexe.
c. Le domaine C-terminal d’Astrin est responsable de la localisation au kinétochore uniquement lorsque l’attachement end-on et la tension sont établis.
- Cette localisation dépend d’un environnement kinétochorien déphosphorylé, consécutif à l’éloignement du gradient d’Aurora.
- Il repose sur une interaction avec le réseau KMN, en particulier avec le complexe NDC80 engagé sur le microtubule.

Astrin marque ainsi spécifiquement les kinétochores bi-orientés, attachés end-on à des microtubules provenant de pôles opposés et mécaniquement stabilisés en vue de la transition métaphase-anaphase.
2. SKAP (KNSTRN), dont la structure exacte n'est pas encore résolue, contient un domaine de liaison direct aux microtubules essentiel à la fonction du complexe.
- Cette propriété de SKAP est requise pour une localisation kinétochorienne robuste et la stabilisation des interactions sous tension.
- Elle confère au complexe une affinité sélective pour les microtubules stables, caractéristiques des attachements end-on matures.
(Figure : vetopsy.fr d'après kern et coll)
3. LC8 et MYCBP participent à l’intégrité et au recrutement du complexe.
- LC8 (DYNLL1), chaîne légère de la dynéine, n'agit pas comme moteur, ni comme facteur de transport, mais comme adaptateur structural et stabilisateur.
- MYCBP n’est pas ici un régulateur transcriptionnel, mais intervient dans la stabilité globale du complexe, son assemblage correct, et son recrutement efficace aux kinétochores bi-orientés.
Recrutement
et rôle
1. Astrin-SKAP agit comme un capteur fonctionnel de l’état correct de l’attachement, distinct des plateformes du point de contrôle du fuseau (SAC).
Le complexe est recruté par :
- la formation d’un attachement end-on mature impliquant NDC80,
- l’établissement d’une tension bipolaire suffisante,
- l’absence d’interactions kinétochoriennes non productives, i.e. non attachées ou latérales.
2. Le rôle protecteur du complexe ne bloque pas la correction d’erreurs en amont, mais verrouille les attachements corrects une fois la tension établie en :
- renforçant la stabilité mécanique des attachements kinétochore-microtubule,
- protégeant localement le complexe NDC80 contre la phosphorylation par Aurora B,
- limitant les cycles inutiles de déstabilisation lorsque la biorientation est atteinte.
3. Astrin-SKAP ne se limite pas à l’ancrage du microtubule, mais améliore les propriétés mécaniques de l’interface kinétochore-microtubule en réduisant les contraintes de friction (The Astrin-SKAP Complex Reduces Friction at the Kinetochore-Microtubule Interface 2023).
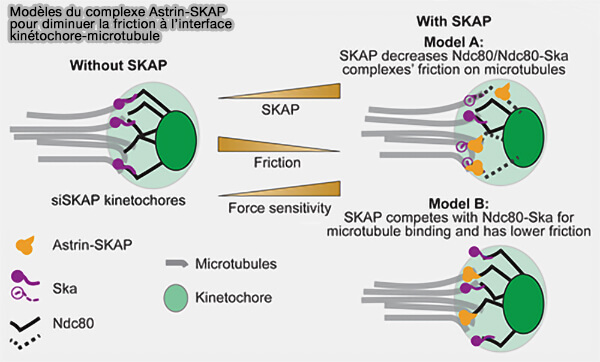
(Figure : vetopsy.fr d'après Rosas-Salvans et coll)
Par son accumulation sélective sur les kinétochores sous tension, Astrin-SKAP signale localement que l’état d’attachement est compatible avec la progression mitotique, ce qui :
- favorise l’extinction indirecte de la signalisation du point de contrôle du fuseau (SAC),
- accompagne la transition vers une organisation du kinétochore dominée par le cœur du réseau KMN, caractérisé par des attachements end-on stabilisés et vérouillés et par la résorption de la corona fibreuse.
Remarque : les complexes RZZ et Astrin-SKAP définissent deux états mutuellement exclusifs du kinétochore :
- un état exploratoire et signalétique (RZZ, SAC actif),
- un état stabilisé et permissif (Astrin-SKAP, SAC levé), assurant la transition ordonnée vers la métaphase stable et l’entrée en anaphase.
Retour à la mitose
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


