Système endo-lysosomal
Endosomes précoces
Complexe d'attache : CORVET
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Vue d'ensemble des endosomes précoces
- Devenirs des endosomes précoces
- Composants des endosomes précoces
- Rab5 et ses régulateurs
- Rab5 et ses effecteurs
- Complexes d'attache des endosomes précoces : complexe CORVET
- Complexe de tri et de recyclage des endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

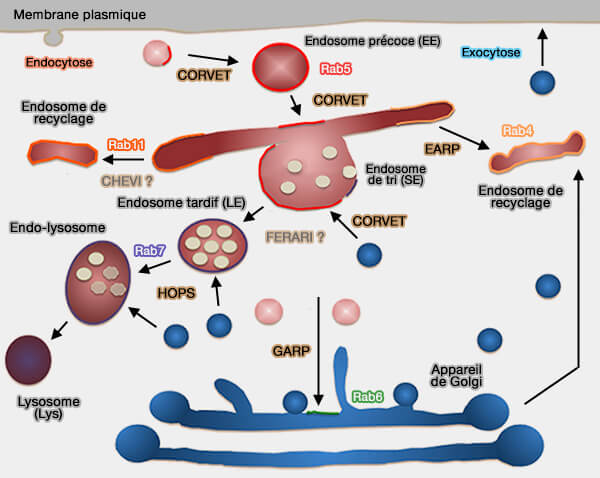
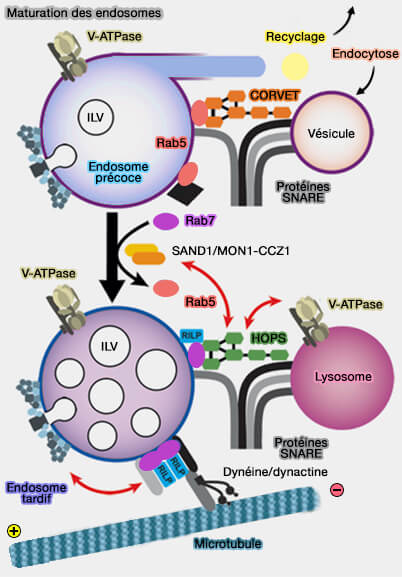
Des complexes d'attache, dont le complexe CORVET, déterminent plusieurs sub-populations d'endosomes précoces et facilite la conversion de l'endosome précoce en endosome tardif.
Les endosomes précoces, comme tous les endosomes, forment un groupe hétérogène d'organites, qui jouent un rôle majeur dans le tri des molécules dans le système endomembranaire.
Les endosomes précoces sont caractérisée par la présence :
1. de PI(3)P (
2. de la petite GTPase Rab5, ses régulateurs, i.e. GEF, GAP et GDI et ses effecteurs :
- l'APPL1/2,
- l'EEA1 et la rabaptine-5,
- la rabénosyne-5,
- le ZFYVE21
- la rabankyrine-5,
- le complexe PI3KCIII-C2.
3. de protéines d'attache comme le complexe CORVET,
Remarque : APPL1/2 et EEA1 peuvent aussi être qualifiés de complexes d'attache.
(Figure : vetopsy.fr d'après Spang)
4. de complexes qui permettent le tri ou le recyclage des cargos, dont les principaux sont :
- le rétromère,
- le complexe retriever et le complexe CCC,
- les complexes CHEVI et FERARI,
- le complexe WASH qui active le complexe Arp2/3 pour induire la polymérisation de l'actine sur les endosomes, en liaison avec les complexes précédents.
Complexe CORVET
CORVET est un complexe d'attache qui facilite la conversion de l'endosome précoce en endosome tardif.

Le complexe CORVET favorise la fusion des membranes Rab5-positives, i.e. fusion homotypique des endosomes qui ne contiennent pas EEA1.
Vue d'ensemble
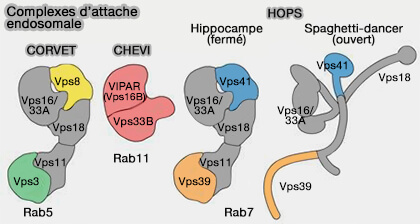
1. Le complexe d'amarrage CORVET (class C CORe Vacuole/Endosome Tethering) sert d'attache à Rab5 (Membrane Tethering Complexes in the Endosomal System 2016 et Characterization of the Mammalian CORVET and HOPS Complexes and Their Modular Restructuring for Endosome Specificity 2015).
(Figure : vetopsy.fr d'après van der Beck et coll)
Le complexe CORVET, initialement identifié chez la levure, se compose de six sous-unités (Characterization of the Mammalian CORVET and HOPS Complexes and Their Modular Restructuring for Endosome Specificity 2015) :
- Vps3 (TGFBRAP1 mammalien) et Vps8 interagissant avec Rab5,
- Vps11 (Vacuolar Protein Sorting 11),
- Vps16,
- Vps18 et Vps33A de la famille des protéines SM ou Sec1/Munc18,
Un mini-CORVET est présent chez la drosophile avec seulement quatre sous-unités Vps16, Vps18, Vps33A et Vps8 (MiniCORVET is a Vps8-containing early endosomal tether in Drosophila 2016).
Remarque : Vps11, Vps16, Vps18 et Vps33A sont communes avec le complexe HOPS, Vps3 et Vps8 sont remplacées par VPS39 et Vps41.
2. CORVET se localise sur les membranes endosomales précoces, et potentiellement aussi sur des porteurs endocytaires et des macropinosomes fraîchement générés (Tethering complexes in the endocytic pathway: CORVET and HOPS 2013).
Vps3 et Vps8
Vps3 et Vps8 de CORVET
1. Vps3 (TGFBRAP1 mammalien) et Vps8 interagissent avec Rab5 (Vps21 de la levure) et fournissent ainsi le lien vers l'organite avec lequel la fusion doit être initiée, i.e. les endosomes précoces (Mammalian CORVET Is Required for Fusion and Conversion of Distinct Early Endosome Subpopulations 2014).
- D'une part, Vps3 et Vps8 sont chacun en contact avec l'un des deux partenaires de fusion (The HOPS/class C Vps complex tethers membranes by binding to one Rab GTPase in each apposed membrane 2015).
- D'autre part, ils se lient avec Vps11 et Vps16.
2. L'épuisement de Vps3 ou de Vps8 inhibe la fusion homotypique des endosomes précoces et altère la conversion des endosomes précoces en endosomes tardifs.
-
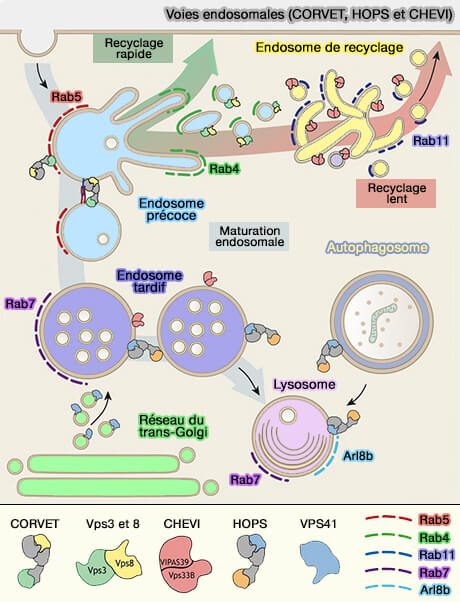
Voies endosomales (CORVET, HOPS et CHEVI)
(Figure : vetopsy.fr d'après van der Beck et coll) - Cela explique peut-être pourquoi l'épuisement de Vps3 ou Vps8 n'affecte pas considérablement la biogenèse lysosomale ou la capacité endocytaire globale des cellules.
- De plus, le recyclage du récepteur de la transferrine (TfR) n'est pas sensiblement affecté après l'épuisement de Vps3 ou Vps8.
Vps3 et Vps8
indépendants
de CORVET
Chez les mammifères, Vps3 et Vps8 sont retrouvés sur des endosomes précoces ainsi que sur des vésicules de recyclage Rab4-positives qui contiennent des intégrines 5 et 1 (Vps3 and Vps8 control integrin trafficking from early to recycling endosomes and regulate integrin-dependent functions 2018 et CORVET, CHEVI and HOPS – multisubunit tethers of the endo-lysosomal system in health and disease 2019).
1. Les intégrines sont les principaux récepteurs des protéines de la matrice extracellulaire (ECM).
- Elles sont essentielles aux interactions cellule-matrice extracellulaire (ECM) et à la migration cellulaire (Integrin traffic – the update 2015 et Endocytic Trafficking of Integrins in Cell Migration 2015).
- Leur niveau de surface cellulaire est régulé par l'équilibre entre endocytose, recyclage endosomal et dégradation lysosomale.
2. Vps3 ou Vps8 inhibe le transport des intégrines endocytées des endosomes précoces vers les endosomes de recyclage positifs pour Rab11-CHEVI et affecte par conséquent l'adhésion cellulaire dépendante de l'intégrine, la migration et la formation d'adhésion focale.
- Ce rôle est indépendant du complexe CORVET et pourrait dépendre du complexe retriever.
- D'autres protéines que les intégrines pourraient être concernées.
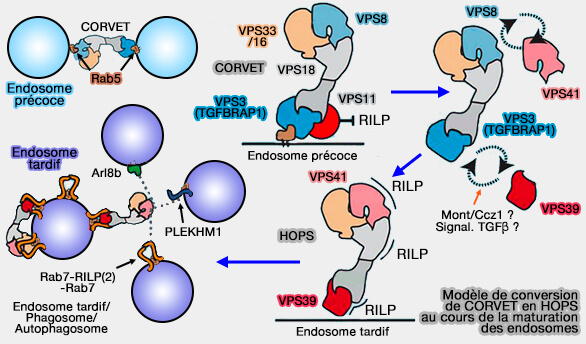
(Figure : vetopsy.fr d'après van der Kant et coll)
Vps11
1. VPS11 est le récepteur central pour les sous-unités spécifiques de CORVET et de HOPS.
2. Chez les mammifères, VPS3/TGFBRAP1 de CORVET et VPS39 de HOPS sont liés au même domaine dans VPS11, ce qui implique que ces deux protéines pourraient entrer en compétition pour la liaison de VPS11.
-
Interactions VIPAS39/
VPS33BVPS8 VPS11 VPS16 VPS33A VIPAS39/
VPS33BOui Non Non Non Non TGFBRAP1
VPS3Non Oui Oui Non Oui VPS8 Non Oui Oui Non - VPS11 Non Oui Oui Oui Oui VPS16 Non Oui Oui Oui Oui VPS33A Non - Oui - Oui
Or, comme VPS3/TGFBRAP1 se lie à VPS11 et VPS11 se lie à l'effecteur RILP (RAB7 interacting lysosomal protein) du complexe HOPS des mammifères, il se pourrait que CORVET soit recruté sur les endosomes tardifs, ce qui n'est jamais le cas.
Un mécanisme de régulation dans lequel la liaison de VPS3/TGFBRAP1 à VPS11 dans le complexe CORVET empêche la liaison de VPS11 à HOPS, bloquant ainsi le ciblage de VPS11 vers les endosomes tardifs et l'assemblage prématuré du complexe HOPS sur ce mêmes endosomes.

Un tel mécanisme permettrait de sauvegarder un assemblage séquentiel du CORVET et du HOPS et ainsi d'échelonner les événements de fusion des endosomes précoces et des endosomes tardifs.
Vps16
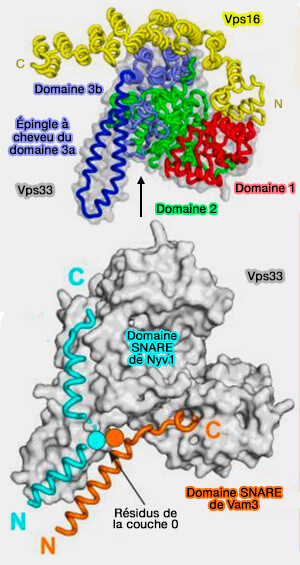
(Figure : vetopsy.fr d'après Baker et coll)
1. Vps16 est retrouvé aussi bien dans le complexe CORVET que dans le complexe HOPS.
2. Un homologue de Vps16, appelé aussi Vps16B/SPE-39 est retrouvé dans le complexe CHEVI.
Vps18
Vps18 se lie avec Vps33A/Vps16, mais pas avec Vps8, contrairement à Vps41 du complexe HOPS.
Remarque : VPS8 de CORVET, qui possède une structure identique à VPS41, mais plus longue qui se finit par une région désordonnée, ne peut se lier à VPS18.
Vps33
1. Chez les métazoaires, deux protéines Vps33 sont présentes : VPS33A et VPS33B (Recruitment of VPS33A to HOPS by VPS16 Is Required for Lysosome Fusion with Endosomes and Autophagosomes 2015).
- CORVET et HOPS des mammifères contiennent tous deux VPS33A.
Ce n'est pas le cas de C. elegans, dont les isoformes ont divergé il y a plus longtemps et sont donc plus différentes que celles des mammifères (Loss of the Sec1/Munc18-family proteins VPS-33.2 and VPS-33.1 bypasses a block in endosome maturation in Caenorhabditis elegans 2013).
- CHEVI, un autre complexe de ciblage additionnel propre aux mammifères, contient VPS33B et un homologue de Vps16, Vps16B/SPE-39.
2. Vps33A et Vps33B sont tous deux membres de la famille des protéines SM ou Sec1/Munc18 (Crystal structures of the Sec1/Munc18 (SM) protein Vps33, alone and bound to the homotypic fusion and vacuolar protein sorting (HOPS) subunit Vps16 2013).
(Figure : vetopsy.fr d'après Solinger et Span)
Les protéines Vps33 et potentiellement d'autres protéines SM, par le biais d'interactions directes avec leurs partenaires SNARE spécifiques (Soluble N-ethylmaleimide-sensitive factor Attachment protein REceptors) :
- catalysent l'assemblage du complexe SNARE grâce à la reconnaissance des t-SNARE (t pour target, cible) spécifiques pour générer des intermédiaires d'assemblage SNARE partiellement zippés (A direct role for the Sec1-Munc18-family protein Vps33 as a template for SNARE assembly 2016),
- veillent à ce que seul l'assemblage SNARE correct soit autorisé à procéder à la promotion de la fusion membranaire.
Vps33A interagit avec (Sec1/Munc18 protein Vps33 binds to SNARE domains and the quaternary SNARE complex 2012) :
- le complexe SNARE endocytaire formé de Q-SNARE (t-SNARE), i.e. Qa-SNARE ou syntaxine 7 (STX7), Qb-SNARE ou Vti1b, Qc-SNARE ou syntaxine 8 (STX8), et de R-SNARE (v-SNARE), i.e. VAMP7 (trans-SNARE complex assembly and yeast vacuole membrane fusion 2007),
- le complexe SNARE autophagique comprenant STX7, VAMP8 ou VAMP7 et SNAP-29 (Proteomic and Biochemical Comparison of the Cellular Interaction Partners of Human VPS33A and VPS33B 2018 et The HOPS complex mediates autophagosome–lysosome fusion through interaction with syntaxin 17 2014 et The Biogenesis of Lysosomes and Lysosome-Related Organelles 2014).
Vps33B est un interacteur connu de la protéine SNARE Sec22B (
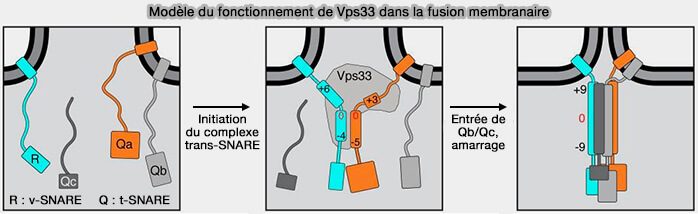
(Figure : vetopsy.fr d'après Baker)

La fusion vésiculaire est traitée, plus en détail, avec les protéines SNARE.
3. Les complexes CORVET ou HOPS, lorsqu'ils sont liés au complexe SNARE zippé via Vps33A, favorisent la fusion membranaire (A Tethering Complex Drives the Terminal Stage of SNARE-Dependent Membrane Fusion 2017).
- La forme volumineuse du CORVET et du HOPS, en forçant une courbure sur les membranes opposées, diminue ainsi l'énergie requise pour la formation de pores de fusion.
- Après la formation des pores de fusion, HOPS et CORVET contribuent également à l'expansion des pores (SNARE-mediated membrane fusion arrests at pore expansion to regulate the volume of an organelle 2018).
Étant donné que ces processus reposent sur la taille physique du CORVET et du HOPS, on ne sait pas si cette fonction peut être extrapolée au complexe CHEVI de petite taille.
Complexes de tri ou de recyclage des cargos : rétromère
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


