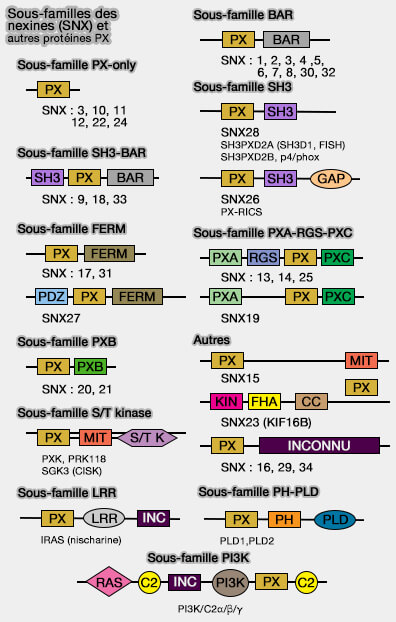
Système endo-lysosomal
Nexines de tri du rétromère (2)
SNX3
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Vue d'ensemble des endosomes précoces
- Devenirs des endosomes précoces
- Composants des endosomes précoces
- Rab5 et ses régulateurs
- Rab5 et ses effecteurs
- Complexes d'attache des endosomes précoces : complexe CORVET
- Complexe de tri et de recyclage des endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation
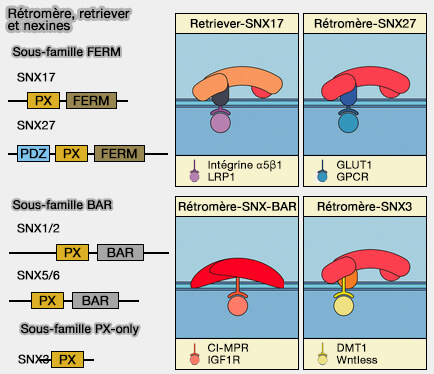
Le rétromère et ses complexes affiliés, i.e. retriever et CCC, jouent un rôle important dans la modulation du trafic endocytaire classique et dans la régulation de l'homéostasie mitochondriale (
(Figure : vetopsy.fr d'après Vieira et coll)
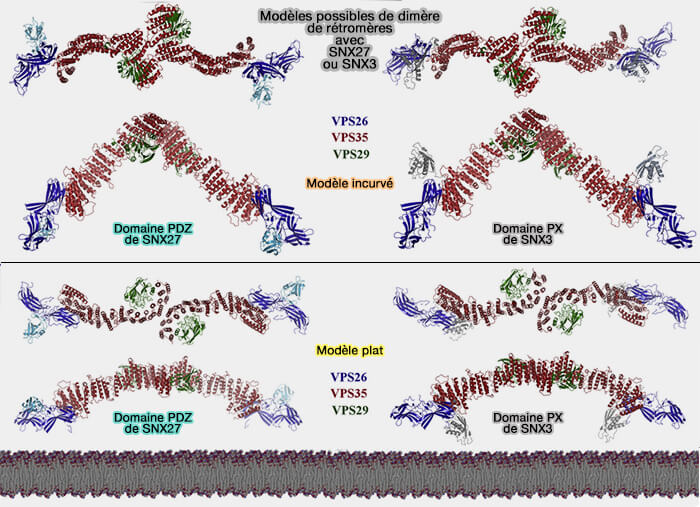
1. Le rétromère canonique (rétromère/SNX-BAR) est attaché à un dimère de nexine appartenant à la sous-famille BAR :
- SNX1 ou SNX2, i.e. équivalent à Vps5 de la levure,
- SNX5, SNX6, i.e. équivalent à Vps17 de la levure.
2. Le rétromère/SNX3 est formé par le rétromère CSC lié à SNX3, une nexine contenant seulement un domaine PX (sous-famille PX-only).

Ces deux voies de transport rétrograde conduisent les cargos au réseau trans-Golgi (TGN) via le réseau de microtubules (Microtubule motors mediate endosomal sorting by maintaining functional domain organization 2013).
3. Le rétromère/SNX27 est formé par le rétromère CSC lié à SNX27, une nexine appartenant à la sous-famille FERM.

Cette voie recycle les cargos directement vers la membrane plasmique via le réseau de microtubules.
Remarque : Snx17 est impliqué dans le complexe retriever, un complexe rétromère-like.

La complexité de la biologie des rétromères chez les métazoaires reflète probablement à la fois l'augmentation du nombre de cargos et la diversité des routes de trafic à partir des endosomes.
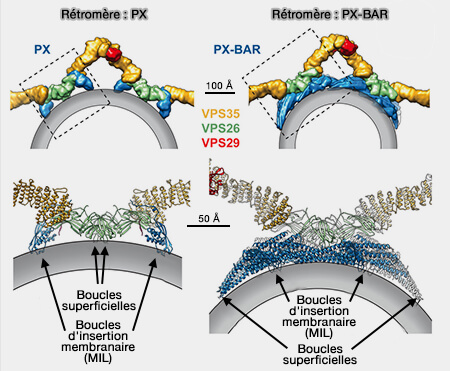
(Figure : vetopsy.fr d'après Wang et all)
Rétromère/SNX3
1. Le rétromère/SNX3 est formé par le rétromère CSC lié à SNX3.
SNX3 ne contient qu'un domaine PX (sous-famille PX-only), qui, quoique sans domaine BAR, peut provoquer une tubulation in vitro.

Cette voie de transport conduit les cargos au réseau trans-golgi (Retromer: A Master Conductor of Endosome Sorting 2014).
Remarque : chez les champignons, le seul adaptateur SNX connu est l'homologue de SNX3, Grd19 (Grd19/Snx3p functions as a cargo-specific adapter for retromer-dependent endocytic recycling 2007).
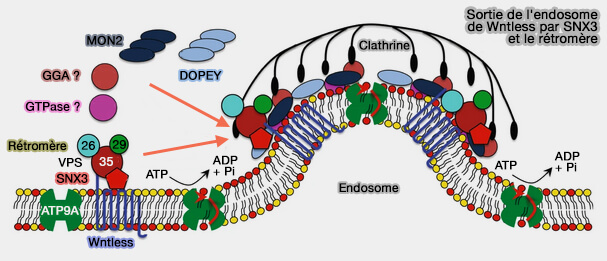
Liaison avec PI(3)P
(Figure : vetopsy.fr d'après Leneva et coll)
1. SNX3, via son domaine PX, interagit avec PI(3)P sur les endosomes précoces (
SNX3 est impliqué :
- dans le recyclage de récepteurs,
- dans la formation des endosomes multivésiculaires (MVE/MVB) - Hrs and SNX3 Functions in Sorting and Membrane Invagination within Multivesicular Bodies 2008 -, de manière similaire à son homologue plus faiblement exprimé Snx12 (SNX12 Role in Endosome Membrane Transport 2012).
2. Son rôle serait essentiel pour :
- le récepteur WNTless de la voie de signalisation WNT, voie majeure dans la spécification cellulaire, la prolifération et la différenciation, la polarité cellulaire et la morphogenèse (SNX3-retromer requires an evolutionary conserved MON2:DOPEY2:ATP9A complex to mediate Wntless sorting and Wnt secretion 2018),
- le récepteur de la transferrine ou TfR (Snx3 Regulates Recycling of the Transferrin Receptor and Iron Assimilation 2013),
- l'isoforme II du transporteur de métal divalent 1 ou DMT1-II étudié dans le paragraphe suivant (The Divalent Metal Transporter 1 (DMT1) Is Required for Iron Uptake and Normal Development of Oligodendrocyte Progenitor Cells 2018).Divalent metal transporter 1 (DMT1) in the brain: implications for a role in iron transport at the blood-brain barrier, and neuronal and glial pathology 2015).
(Figure : vetopsy.fr d'après McGough et coll)
Liaison avec VPS26/35 du rétromère
Le domaine PX de SNX3 interagit avec VPS26 et VPS35 du rétromère.
Les interactions avec la membrane et le rétromère se produisent sur les côtés opposés du domaine PX de SNX3, ce qui est cohérent avec le fait que SNX3 est une protéine d'échafaudage qui recrute le rétromère à la surface membranaire (Structural Mechanism for Cargo Recognition by the Retromer Complex 2016).
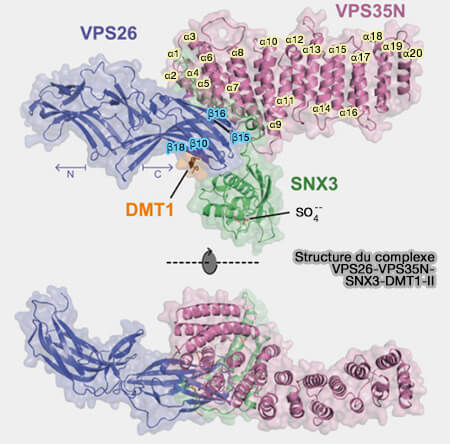
(Figure : vetopsy.fr d'après Lucas et coll)
L'interaction entre SNX3 et le rétromère s'effectue via trois interfaces distinctes.
1. La queue N-terminale (résidus 3 à 28) de SNX3 adopte une conformation sinueuse le long de l'interface VPS26/VPS35, en alternant les contacts avec les deux sous-unités.
Ces interactions peuvent être :
- spécifiques dans la région proximale, i.e. Y22 de SNX3 créant des liaisons hydrogènes avec N191 et Q249 dans un sillon entre les hélices α8 et α10 de VPS35,
- moins spécifiques dans la région distale de l'extrémité N-terminale de SNX3, compatible avec la conservation de cette région.
2. La deuxième interface avec VPS35 implique E30 et D32 de SNX3, qui établissent des liaisons hydrogène avec H202, S203 et R204 de VPS35.
3. La troisième interface avec VPS26 est effectuée par P133 de SNX3, qui se place dans une cavité hydrophobe à la pointe du sandwich C-terminal comprenant I170, I202 et Y286 de VPS26.
Remarque : si la liaison de SNX3 à PI(3)P semble suivre un mécanisme canonique, l'interaction avec le rétromère implique à la fois des extensions flexibles et des segments rigides du domaine PX dans une association multi-interface avec les sous-unités VPS26 et VPS35.
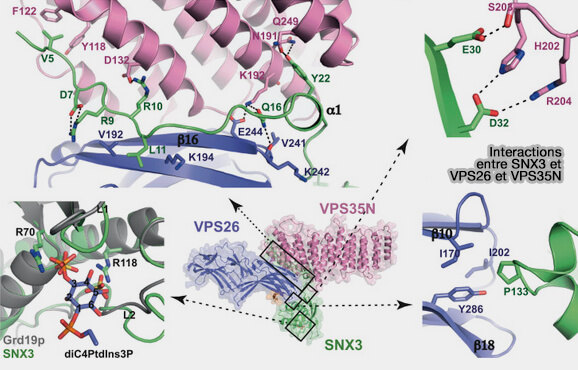
(Figure : vetopsy.fr d'après Lucas et coll)
Formation de tubules
1. Jusqu'à récemment, on pensait que seules les protéines SNX-BAR généraient la courbure requise pour la tubulation, et que cette tubulation n'avait aucun rapport avec le rétromère (
SNX3/rétromère induit une tubulation in vitro en l'absence de domaine BAR, i.e. les BAR ne sont pas nécessaires pour la tubulation membranaire dans ce contexte.
2. Les revêtements SNX3/rétromère se composent d'unités en forme d'arc formées (Architecture and mechanism of metazoan retromer:SNX3 tubular coat assembly 2021) :
- d'homodimères VPS35 asymétriques,
- de dimères VPS26,
- deux molécules SNX3 localisées au niveau de la membrane.
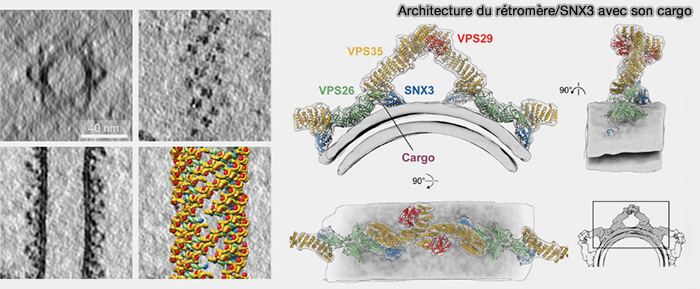
(Figure : vetopsy.fr d'après Leneva et coll)
SNX3 se lie :
- au rétromère à une interface située entre les sous-unités VPS26 et VPS35, avec sa poche de liaison PI(3/P tournée vers la membrane,
- à la membrane à l'aide d'une boucle d'insertion de membrane (MIL) caractéristique trouvée dans d'autres domaines PX de liaison à la membrane (
domaine PX et liaisons aux phosphoinositides).
3. Les arcs de VPS35 sont asymétriques.
Le monomère VPS35 apparaît plus incurvé, et les deux sous-unités VPS35 forment une interface dimère asymétrique utilisant des résidus électrostatiques (Mammalian Retromer Is an Adaptable Scaffold for Cargo Sorting from Endosomes 2020).
- Cet assemblage asymétrique d'arcs pourrait imposer la directionnalité et la stoechiométrie de la liaison de l'adaptateur aux manteaux.
- Les arcs rétromères forment un échafaudage qui contribue ou aide à soutenir la flexion de la membrane et peut aider à propager la courbure et la tubulation sur de longues distances par oligomérisation.
(Figure : vetopsy.fr d'après Kendall et coll)
Reconnaissance du cargo
La liaison de SNX3 à VPS26 engendre un mouvement vers l'extérieur du brin β10 e VPS26, qui génère une poche hydrophobe entre les brins β10 et β18 dans le contexte du complexe.
1. Une séquence au motif consensus Øx/L/M/V, dans lequel Ø est un résidu aromatique volumineux F/Y/W, qui sert de sélection du cargo par le rétromère, est perpendiculaire à β10 et β18 de VPS26.
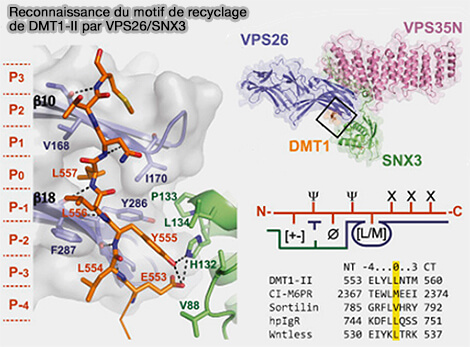
(Figure : vetopsy.fr d'après Lucas et coll)
Ce motif ressemble au signal de recyclage (551QPELYLL557) de l'isoforme II du transporteur de métal divalent 1 (DMT1-II), un cargo qui circule entre les endosomes et la membrane plasmique (Retromer-mediated direct sorting is required for proper endosomal recycling of the mammalian iron transporter DMT1 2010).
- L557 de DMT1-II est complètement enfouie dans la poche hydrophobe entre les brins β10 et β18 de VPS26 et correspond au P0.
- Le signal de recyclage de DMT1-II établit un vaste réseau de liaisons hydrogène et d'interactions hydrophobes engageant à la fois SNX3 et VPS26 et est donc concomitant avec l'interaction SNX3/rétromère.
2. Toutefois, il semble qu'il faille au moins deux motifs sur les cargos pour leur tri (A bipartite sorting signal ensures specificity of retromer complex in membrane protein recycling 2019).
- De très nombreux cargos possèdent le motif consensus Øx/L/M/V.
- Au moins chez la levure, d'autres motifs comme SSL dans Vps10, FQFND dans Ste13, YEF dans Kex2 et WKY of Stv1 permettent de les sélectionner plus précisément.
SNX27
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


