Transport des lipides
Transporteur ABC : ABCA1
Structure et fonctions
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le transporteur ABCA1, transporteur ABC, transporteurs à cassettes liant l'ATP (ATP Binding Cassette en anglais) possèdent de nombreuses fonctions, dont celle de créer des microdomaines au niveau de la membrane plasmique pour former des HDL-C, HDL naissantes contenant du cholestérol.
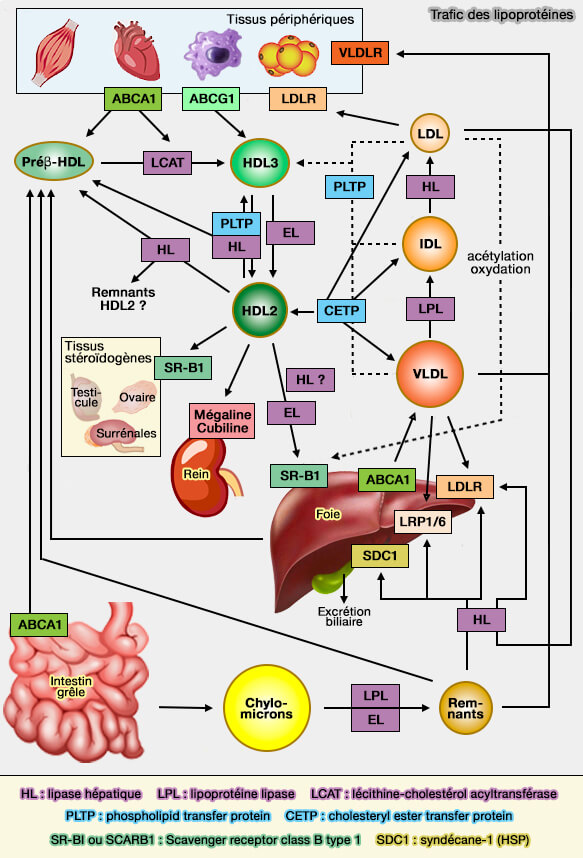
(Figure : vetopsy.fr)

Les transporteurs ABC et leur mécanisme d'action sont étudiés dans des chapitres spécifiques.
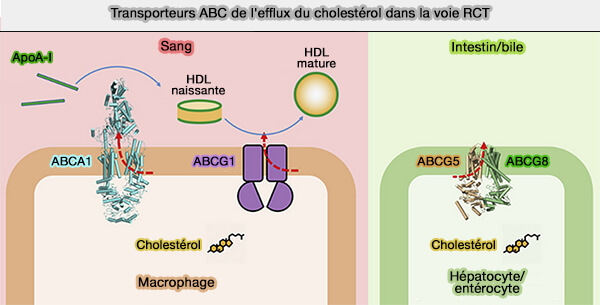
(Figure : vetopsy.fr d'après Xu et coll)

Les comparaisons entre les transporteurs ABCG1, ABCG5/8 et ABC1 sont étudiées dans : Molecular basis of cholesterol efflux via ABCG subfamily transporters (2021).
Vue d'ensemble et fonctions d'ABCA1
1. ABCA1 est une protéine ubiquitaire qui se trouve dans :
- le foie, sur le surface basolatérale des hépatocytes,
- les entérocytes ((Intestinal ABCA1 directly contributes to HDL biogenesis in vivo 2006).
- les macrophages (Apolipoprotein A-I but not high-density lipoproteins are internalised by RAW macrophages: roles of ATP-binding cassette transporter A1 and scavenger receptor BI 2008),
- les cellules endothéliales (Carboxyl Terminus of Apolipoprotein A-I (ApoA-I) Is Necessary for the Transport of Lipid-free ApoA-I but Not Prelipidated ApoA-I Particles through Aortic Endothelial Cells 2011).
- le cerveau,
- divers autres tissus.
ABCA1 se retrouve dans des vésicules endocytaires pour voyager des endosomes à la surface cellulaire (Cellular Localization and Trafficking of the Human ABCA1 Transporter 2001).

Les fonctions d'ABCA1 sont nombreuses et détaillées dans : The Role of the ATP-Binding Cassette A1 (ABCA1) in Human Disease (2021).
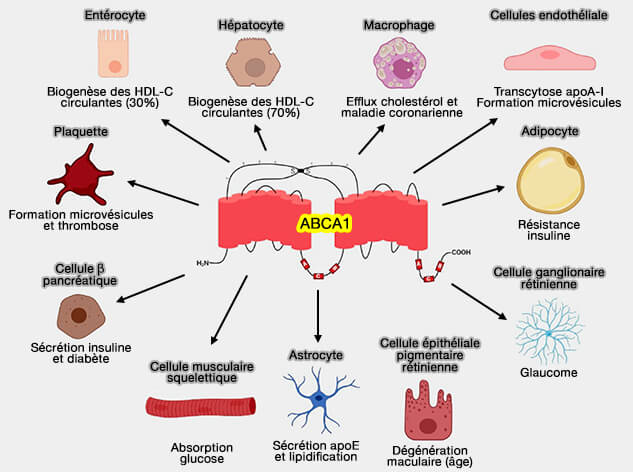
(Figure : vetopsy.fr d'après Segrest et coll)
2. ABCA1 favorise l'efflux des phospholipides (PL) et et du cholestérol vers les apoA-I sans lipides ou peu lipidés ou vers d'autres apolipoprotéines, comme l'apoE et l'apoA-IV, mais pas aux HDL sphériques.
Le rôle clé d'ABCA1 dans la voie RCT (transport inverse du cholestérol) et le métabolisme des HDL est évident car les mutations du gène ABCA1 à l'origine de la maladie de Tangier sont associées à des taux plasmatiques extrêmement faibles de HDL-C, une caractéristique de la maladie (Tangier desease 2023).
Structure d'ABCA1
Structure générale
La structure d'ABCA1, composée de 226 résidus, comprend plusieurs domaines et n'est pas dimérisé comme les transporteurs ABCG (Structure of the Human Lipid Exporter ABCA1 2017) :
- deux domaine extracellulaire (ECD),
- deux domaine transmembranaire (TMD),
- deux domaine de liaison aux nucléotides (NBD).

La structure détaillée des transporteurs ABC est étudiée dans un chapitre spécifique.
1. Les domaines transmembranaire (TMD), TMD1 et le TMD2, contiennent chacun six domaines transmembranaires sans pratiquement aucune extension cytoplasmique.
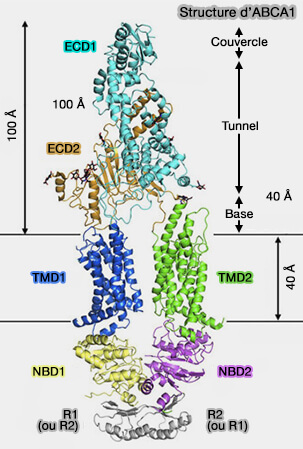
(Figure : vetopsy.fr d'après Philips)
Chaque TMD de ABCA1 contient deux hélices transversales à la limite intracellulaire de la membrane, entre TMD et NBD (
2. Les domaine de liaison aux nucléotides (NBD) cytoplasmiques, NBD1 et NBD2, sont classiques (
3. Les deux domaines régulateurs, RD1 et RD2, sont trouvés à la base des NTD et forment un verrou structurel qui peut stabiliser les NBD et soutenir une coopération efficace entre les deux moitiés d'ABCA1.
Les RD1 et RD2 semblent permuter et former un verrou (The regulatory domains of the lipid exporter ABCA1 form domain swapped latches 2022).
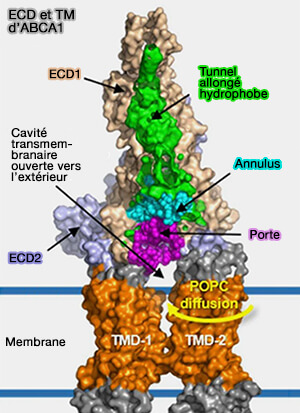
4. Les domaines extracellulaires ECD1 (583 résidus), au-dessus de TMD2, et ECD2 (270 résidus), au-dessus de TMD1, peuvent être divisés en trois couches, de la membrane vers l'extérieur.
a. La base est constituée par ECD1 et d'ECD2.
b. Le tunnel, allongé d'environ 60 Å de hauteur, en grande partie hydrophobe, est principalement formé par des hélices α d'ECD1, i.e. domaine hélicoïdal I, et une épingle à cheveux α-hélicoïdale d'ECD2, i.e. domaine hélicoïdal II.
- Le tunnel est ouvert sur le milieu extérieur aux extrémités distale et proximale.
- Près du couvercle, le tunnel est accessible au solvant par une ouverture étroite qui empêcherait le passage des lipides.
- À l'extrémité proximale, cependant, l'ouverture est suffisamment large pour que les lipides passent à travers.
c. Le couvercle est composé d'un petit domaine α/β de ECD1, se trouve au-dessus du tunnel.
Différences avec les autres transporteurs
La structure d'ABCA1 diffère des autres transporteurs ABC sur plusieurs points (Biomedical Advances in ABCA1 Transporter: From Bench to Bedside 2023).
(Figure : vetopsy.fr d'après Segrest et coll)
1. Les transporteurs ABC forment généralement une cavité entre les deux TMD pour lier et déplacer leurs substrats à travers les membranes.
- Le TMD1 et le TMD2 dans ABCA1 entrent partiellement en contact et ne forment pas de cavité fermée, ce qui conduit à l'exposition des surfaces latérales du TMD à la bicouche lipidique.
- ABCA1 peut permettre l'entrée latérale de substrats lipidiques à partir de la bicouche lipidique.
2. L'alternance entre les conformations TMD tournées vers l'intérieur, i.e. sans ATP, et vers l'extérieur, i.e. lié à l'ATP, permet aux exportateurs ABC de transloquer leurs substrats à travers les membranes (
Le TMD dans ABCA1 sans ATP est dans une conformation tournée vers l'extérieur, ce qui implique que le modèle d'accès alterné n'est pas compatible avec le transfert lipidique dépendant de l'ATP d'ABCA1.
3. Les membres de la sous-famille ABCA, y compris ABCA1, se différencient de la plupart des autres transporteurs ABC en raison de la présence de grands domaines extracellulaires (ECD).
- La membrane plasmique a une épaisseur d'environ 70 à 100 Å et est composé principalement d'une bicouche de phospholipides (PL), i.e. la longueur d'une seule molécule de PL peut varier de 35 à 50 Å,
- Le tunnel hydrophobe de 60 Å peut leur servir de passage.
4. Sur la base de l'analyse structurelle, deux mécanismes d'exportation des PL par ABCA1 ont été proposés.
- Soit, les PL dans le feuillet interne du PM entrent dans l'interface entre TMD1 et TMD2, sont transférés dans la cavité transmembranaire ouverte vers l'extérieur, puis subissent une translocation dans le tunnel hydrophobe.
- Soit, les PL dans le feuillet externe du PM diffusent dans la cavité transmembranaire tournée vers l'extérieur, puis subissent une translocation dans le tunnel hydrophobe.
Rôle d'ABCA1 dans la formation des HDL
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


