Transport des lipoprotéines
Des tissus périphériques au foie
Voie RCT (transport inverse du cholestérol)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le transport des lipoprotéines est effectué par plusieurs voies dont la voie RCT (transport inverse du cholestérol) ou voie de retour des lipides qui ramène le cholestérol en excès des tissus périphériques vers le foie par les HDL (lipoprotéines de haute densité).
Ces voies sont appelées différemment selon les auteurs.
1. La voie d'absorption des lipides peut se diviser en deux.
a. La voie entéro-hépatique, voie entéro-hépatique exogène ou même voie exogène, transporte les lipides exogènes vers le foie par les chylomicrons (CM) et ses remnants (CM-R).
b. La voie d'apport, voie endogène ou centrifuge transporte les lipides du foie vers les tissus périphériques par les VLDL (lipoprotéines de très basse densité), les IDL (lipoprotéines de densité intermédiaire) et les LDL (lipoprotéines de basse densité).
Remarque : le terme voie d'apport peut aussi regrouper les deux voies qui ne contiennent que des lipoprotéines à apo-B.
2. La voie RCT (transport inverse du cholestérol) ou voie de retour des lipides ramène le cholestérol en excès des tissus périphériques vers le foie, i.e. transport centripète par les HDL (lipoprotéines de haute densité) :
- soit pour être éliminé sous forme de cholestérol libre (FC) e ou après transformation en acides biliaires,
- soit pour être recyclé,
- soit pour être stocké sous forme de cholestérol estérifié (CE) dans des gouttelettes lipidiques cytoplasmiques (cLD, Lipid Droplets).
(Figure : vetopsy.fr d'après Xu et coll)
Des tissus périphériques au foie
Vue d'ensemble de la RCT
1. La voie du transport inverse du cholestérol (RCT ou Reverse Cholesterol Transport) ou voie de retour des lipides est défini comme le processus par lequel le cholestérol sort des cellules des tissus périphériques, y compris les cellules spumeuses (foam cell en anglais) des plaques d'athérosclérose, entre dans la circulation et est capté par le foie :
- soit pour être éliminé sous forme de cholestérol libre ou après transformation en acides biliaires,
- soit pour être recyclé.
(Figure : vetopsy.fr)
On parle d'efflux du cholestérol.
En biologie, l'efflux est un mécanisme par lequel les cellules rejettent à l'extérieur des composés toxiques, i.e. mécanisme de transport actif, énergie-dépendant, assuré par des protéines transmembranaires.

Le foie est le principal organe à métaboliser le surplus de cholestérol en l'éliminant par voie biliaire.
2. Les deux tiers du cholestérol retrouvé dans la bile sous forme de cholestérol libre (FC) ou après transformation en acides biliaires, proviennent des lipoprotéines plasmatiques, le reste est issu de la synthèse de novo de cholestérol par le foie.
3. Pour une petite partie, le cholestérol peut également être stocké dans le foie ou dans le tissu adipeux sous forme d’esters de cholestérol par l'action de ACAT1 (Acyl Cholestérol Acyl Transférase ou stérol O-acyltransférase), EC 2.3.1.26, qui provoque l'accumulation de cholestérol estérifié (CE) en gouttelettes lipidiques cytoplasmiques (cLD, Lipid Droplets).

Toutefois, il n'y a pas d’organes de stockage à proprement parler : toute synthèse excessive ou tout apport excessif de cholestérol provoquera des dépôts dans les tissus comme dans les vaisseaux sanguins (
Voies de la RCT
1. Le cholestérol excédentaire peut être rapatrié des tissus périphériques vers le foie par deux voies.
a. La voie principale, voie directe ou extra-lysosomale :
- élimine le cholestérol libre par les voies biliaires,
- utilise les HDL (lipoprotéines de haute densité) qui sont captées par SR-B1 ou SCARB1 (Scavenger receptor class B type 1).

Cette élimination du cholestérol par les HDL prévient l'athérosclérose, i.e. on parle dans les analyses de " bon cholestérol ".
b. La voie indirecte ou intra-lysosomale,
- élimine le cholestérol sous forme d'acides biliaires,
- utilise les VLDL (lipoprotéines de très basse densité) ou les LDL (lipoprotéines de basse densité) dans lesquels le cholestérol est transféré des HDL par la CETP (Cholesteryl Ester Transfer Protein ou plasma lipid transfer protein), et éliminé par les LDLR (Low-Density Lipoprotein Receptor).

Les acides biliaires, leur biosynthèse et leur cycle entéro-hépatique sont étudiés dans des chapitres spécifiques.
(Figure : vetopsy.fr d'après Oulmet et coll)
2. Dans des conditions normales, environ 95 % des acides biliaires sécrétés sont réabsorbés dans la lumière intestinale par la face apicale des entérocytes par l'ASBT (
80 % du cholestérol libre intestinal est réabsorbé par NPC1L1 (
3. Toutefois, une partie du cholestérol est rejeté dans les selles (
Voie directe de la RCT
(HDL → SR-B1)
La voie directe de la RCT fait appel aux HDL (lipoprotéines de haute densité) et les études portent surtout sur l'efflux du cholestérol et des phospholipides (PL) hors des macrophages (Macrophages in atherosclerosis: a dynamic balance 2013).
- La surcharge du macrophage en cholestérol, principalement sous forme libre, provoque des altérations fonctionnelles et structurelles contribuant à leur mort apoptotique.
- L'athérosclérose est liée aux cellules présentes dans l'épaisseur de la paroi artérielle, en particulier les macrophages et, dans une moindre mesure, les cellules musculaires lisses vasculaires qui migrent de la média à l'intima et les cellules endothéliales (
athérosclérose).
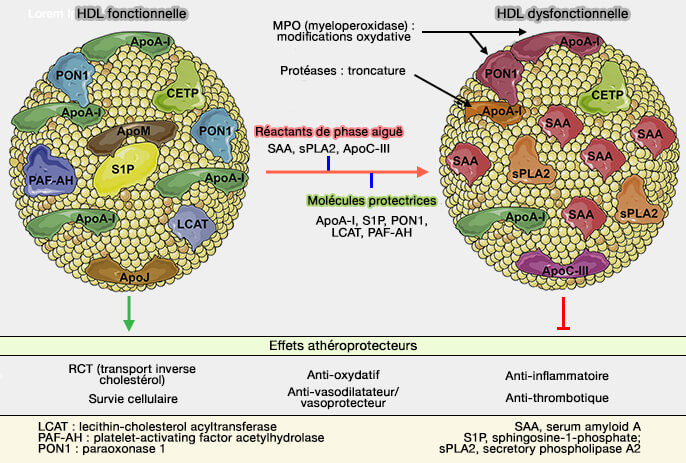
(Figure : vetopsy.fr d'après Soppert et coll)
Les macrophages contiennent du cholestérol, selon leur importance, par (HDL and Reverse Cholesterol Transport 2019) :
- l'internalisation des lipoprotéines plasmatiques,
- la phagocytose des débris lipidiques contenus ou libérés par des cellules apoptotiques,
- la synthèse de novo intracellulaire.
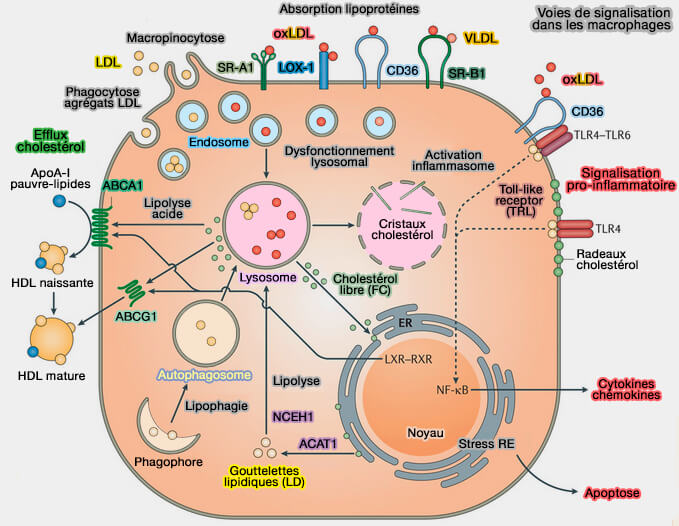
(Figure : vetopsy.fr d'après Moore et coll)
Remarque : Dans le foie et les tissus stéroïdogènes, les esters de cholestérol contenus dans les HDL (lipoprotéines de haute densité) sont principalement éliminés par leur captation sélective via SR-B1 qui semble produire, comme pour les chylomicrons, des remnants.
- Ces remnants, différents des préβ-HDL, s’incorporent exclusivement dans des αHDL préexistantes pour former des particules plus larges
- Cette réassociation des remnants de HDL avec des HDL préexistantes pourraient avoir comme rôles de retenir les apolipoprotéines des HDL dans la circulation après la captation sélective de leurs esters de cholestérol via SR-B1.
Efflux du cholestérol
Les macrophages utilisent plusieurs mécanismes de défense contre la toxicité de ce cholestérol libre (FC).
1. Le FC est estérifié par l'action de ACAT1 (Acyl Cholestérol Acyl Transférase ou stérol O-acyltransférase), EC 2.3.1.26, qui provoque l'accumulation de cholestérol estérifié (CE) en gouttelettes lipidiques cytoplasmiques (cLD, Lipid Droplets).
(Figure : vetopsy.fr)
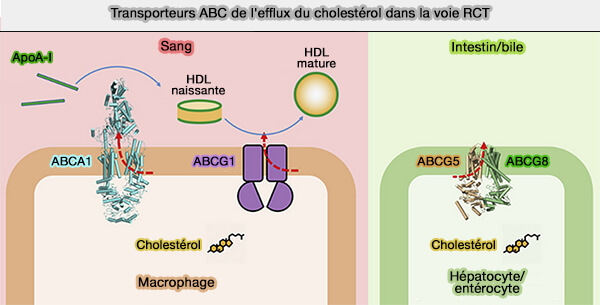
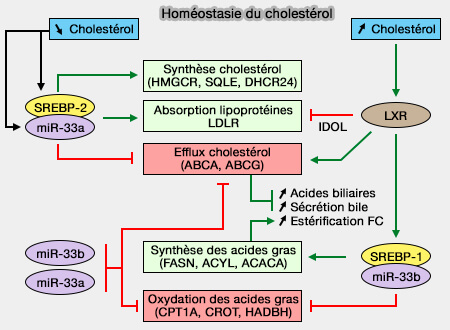
2. Le FC est extrudé à l'extérieur de la cellule par des transporteurs ABC dont la traduction est stimulée par LXR (Liver X Receptor), activé par l'excès de cholestérol intracellulaire (
a. Le cholestérol libre (FC) et les phospholipides (PL) quittent les cellules vers les HDL naissantes et pauvres en lipides (

ABCA1 est capable de se lier à l'apoA-I pour médier la formation de pré-β-HD, LCAT (Lécithine-Cholestérol AcylTransférase) mûrit davantage les particules pré-β-HDL en HDL3.
b. Le FC peut aussi être transféré dans les HDL3 via ABCG1, mais pas vers l'apoA-I sans lipides (ATP-binding cassette transporters G1 and G4 mediate cellular cholesterol efflux to high-density lipoproteins 2004).
3. L'extraction peut aussi passer par SR-B1 dans les HDL3 (High-density lipoprotein heterogeneity and function in reverse cholesterol transport 2010).
4. Enfin, une partie du FC peut diffuser passivement des tissus au pool de HDL naissants et des HDL matures.

La diffusion simple domine l'efflux de cholestérol dans les macrophages normaux, régulé par les concentrations de cholestérol. Dans les macrophages surchargés de cholestérol, ABCA1 et ABCG1 ont un rôle majeur.
Remarque : les macrophages utilisent IDOL pour dégrader LDLR et empêcher ainsi l'absorption de cholestérol par la voie indirecte (
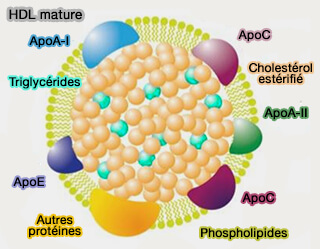
Le cholestérol libre (FC) se transfère rapidement et de manière réversible entre les HDL naissants et les HDL matures.
(Figure : vetopsy.fr d'après Duan et coll)
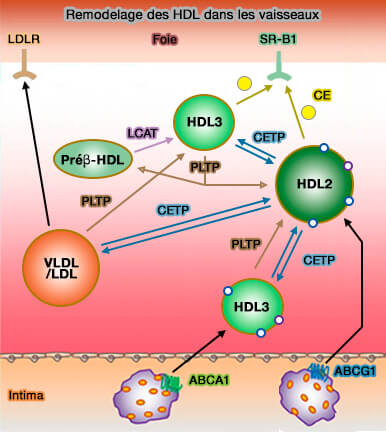
Estérification du cholestérol dans les HDL
1. Les HDL (lipoprotéines de haute densité) convertissent le cholestérol libre (FC) en esters de cholestérol (CE) par LCAT (Lécithine-Cholestérol AcylTransférase) et transforme les LDL3 en LDL2.

LCAT est la seule enzyme capable d'estérifier le cholestérol sur les lipoprotéines plasmatiques.
2. L'estérification du FC par LCAT :
- supprime le transfert inverse du cholestérol libre vers les macrophages de la paroi artérielle,
- favorise leur extraction hépatique pour leur élimination finale.
Cette conversion fournit la force motrice pour que plus de cholestérol libre se déplace le long du gradient de concentration de la membrane plasmique au HDL dans l'espace extracellulaire.
Transfert aux hépatocytes
Les HDL (lipoprotéines de haute densité) transfèrent rapidement leur cholestérol et les phospholipides (PL) aux hépatocytes.
Les demi-vies des différents composants des HDL qui suggère que chacun est extrait par un mécanisme séparé, sont les suivantes :
- l'holoparticule HDL, 5,8 jours,
- les esters de cholestérol (CE), 3,3h,
- le cholestérol libre (FC), 5min,
- les phospholipides (PL), 2min.
1. Le mécanisme principal est le captage par le récepteur SR-B1 ou SCARB1 (Scavenger receptor class B type 1).
- Ce processus serait facilité par la remodelage des lipoprotéines produit par l'hydrolyse des triglycérides et des phospholipides par la lipase hépatique (HL) et la lipase endothéliale (EL).
- SR-B1 favorise l'absorption sélective de cholestérol des HDL tout en les épargnant les composants protéiques, tels que l'apoA-I, qui sont ainsi régénérés et prêts pour un nouveau cycle de transport inverse.
2. Toutefois, le FC des HDL pourrait être transmis aux hépatocytes par des mécanismes spontanés.
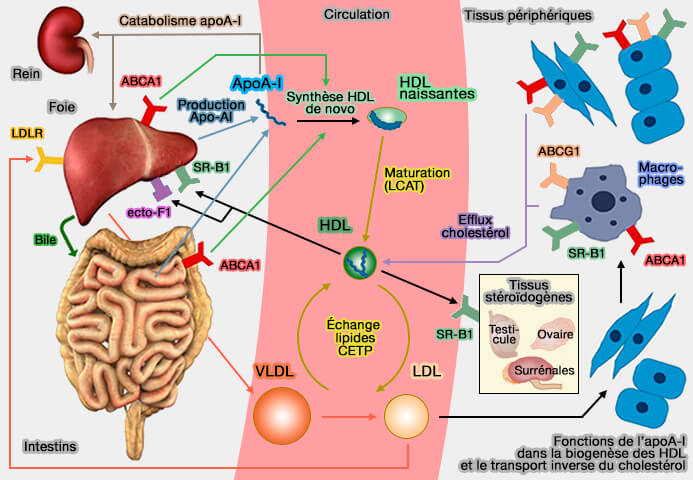
(Figure : vetopsy.fr)
3. Enfin, le cholestérol pourrait être capté par l'absorption des holoparticules d'HDL (
- le récepteur SR-B1, avec EL (Endothélium Lipase) et ABCG1 (Transendothelial transport of lipoproteins 2020),
- CD36, un récepteur scavenger proche de SR-B1,
- l'ecto-F1-ATPase,
- d'autres mécanismes comme la pinocytose.
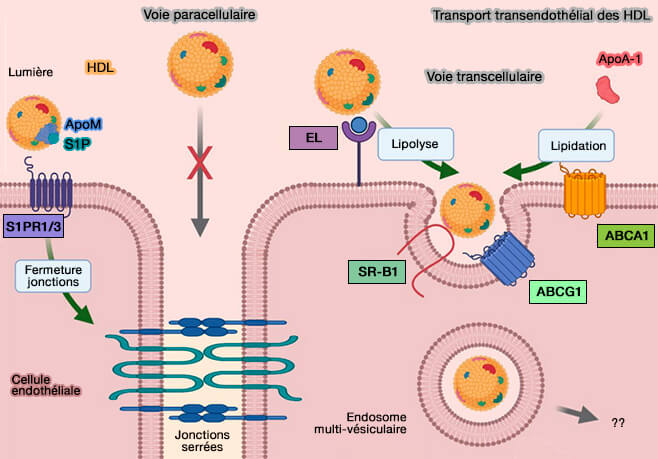
(Figure : vetopsy.fr d'après Robert et coll)
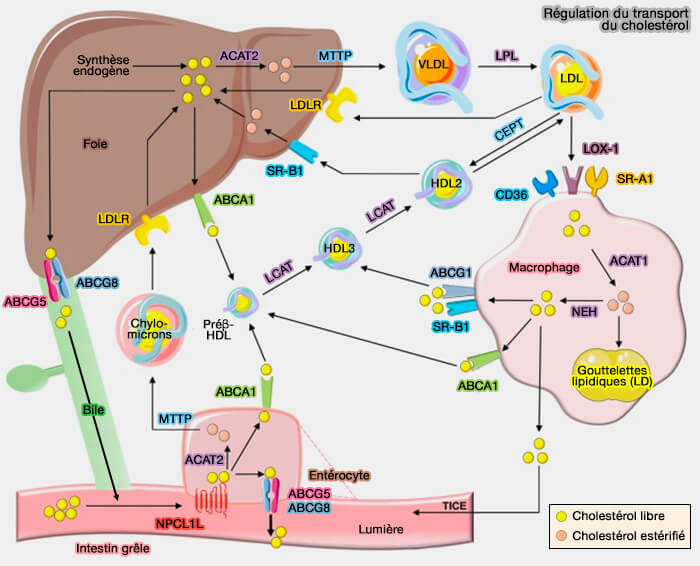
Voie indirecte (HDL-LDL/VLDL→ LDLR)
1. La voie indirecte du RCT implique les transferts de cholestérol entre les HDL (lipoprotéines de haute densité) et les LDL (lipoprotéines de basse densité) :
- soit par échange de lipides via CETP (Cholesteryl ester (CE) Transfer Protein),
- soit par transfert spontané.
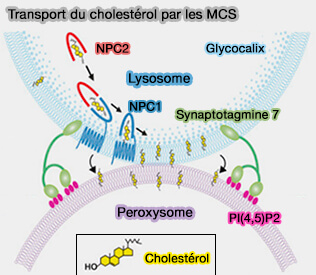
Figure : vetopsy.fr d'après Chu et coll)
2. Les LDL seront absorbées par les hépatocytes via une endocytose médiée par la clathrine des LDLR (
Le trafic intracellulaire nécessiterait, grâce à l'intervention de NPC1 (Niemann–Pick C1) et NPC2 (Niemann–Pick C2) des sites de sites de contact membranaire (MCS) :

Cette voie contribue moins à l'élimination totale du cholestérol libre (FC) que la voie directe par les HDL.
Excrétion du cholestérol
L'excès de cholestérol dans le foie est éliminé dans la bile, puis dans l'intestin afin qu'il soit excrété dans les fèces, i.e. cette étape est considérée comme la dernière phase du RCT et comprend deux phases (A New Model of Reverse Cholesterol Transport: EnTICEing Strategies to Stimulate Intestinal Cholesterol Excretion 2015) :
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


