Lipides : stéroïdes et stérols
Cholestérol : sortie lysosomale
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Dans les lysosomes, les lipoprotéines, en particulier les LDL (lipoprotéines de basse densité), sont dégradées et les esters de cholestérol (CE) sont hydrolysés en cholestérol libre (FC) qui sort dans le cytoplasme pour l'approvisionnement des cellules et pour sa propre homéostasie.
(Figure : vetopsy.fr d'après Gwang-woong Go)
Vue d'ensemble de la sortie lysosomale du cholestérol
Dans les lysosomes, après endocytose des lipoprotéines, les esters de cholestérol (CE) sont hydrolysés par la LAL ou LIPA (lipase lysosomale), en cholestérol libre (FC).
1. Le cholestérol libre (FC) sort des lysosomes pour l'approvisionnement des cellules et pour sa propre homéostasie et il peut :
- soit retourner dans la membrane plasmique ou le réticulum endoplasmique (RE) avec l'aide de la LTP (protéine de transfert des lipides) ORP1L,
- soit être incorporé dans les lipoprotéines,
- soit être éliminé par la voie des acides biliaires, ou directement sous forme libre (
excrétion du cholestérol).
2. La sortie lysosomale du cholestérol nécessite la coopération de deux protéines (Clues to the mechanism of cholesterol transfer from the structure of NPC1 middle lumenal domain bound to NPC2 2016) :
- NPC2 (Niemann–Pick C2), est une protéine soluble luminale.
- NPC1 (Niemann–Pick C1) est une protéine membranaire intégrale.
Les mutations de l'une ou l'autre de ces protéines provoque la maladie de Niemann-Pick de type C (NPC), une maladie mortelle de stockage lysosomal qui entraîne une mort prématurée due à l'accumulation de cholestérol et de glycosphingolipides dans tous les lysosomes.
NPC2
NPC2 est une petite protéine soluble qui lie le cholestérol à l'intérieur de la lumière du lysosome (Structural Insight into Eukaryotic Sterol Transport through Niemann-Pick Type C Proteins 2019).
1. La structure de NPC2 sans stérol est composée par un trimère et chaque monomère adopte un sandwich bêta ouvert immunoglobuline-like avec sept brins bêta anti-parallèles, appelé domaine ML (MD-2-related lipid-recognition).
- Une petite hélice alpha, entre les brins 4 et 5, forme une couverture (résidus 109-123) renfermant une partie d'une cavité hydrophobe profonde et allongée (1 019 Å3) entre les deux côtés du sandwich, laissant de l'espace pour l'entrée et la sortie du substrat à une seule extrémité du sandwich.
- Deux pont disulfure et une seule N-glycosylation stabilisent la structure.
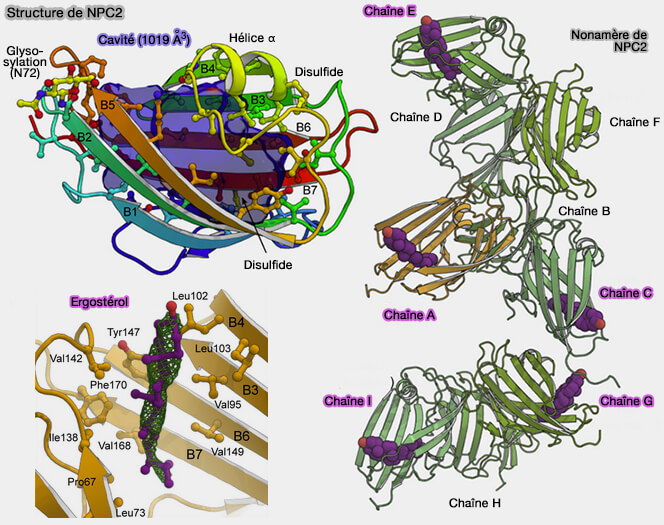
(Figure : vetopsy.fr d'après Winkler et coll)
2. La structure de NPC2 en complexe avec des stérols contient 9 monomères formant 3 trimères similaires au trimère dans la structure sans stérol, i.e. A-C, D-F et G-I.
- Une seule molécule d'ergostérol se trouve dans la cavité de liaison hydrophobe de 5 monomères , i.e. A, C, E, F et I, tandis que les 4 monomères restants ont des caractéristiques de forte densité dans la cavité de liaison qui ne peuvent pas être classées avec certitude mais semblent être plus volumineuses que l'ergostérol et peuvent être d'autres lipides.
- La polarité des stérols dans la cavité est telle que le groupe de tête polaire pointe vers l'avant et la queue aliphatique dans la cavité.
NPC1
NPC1, est une glycoprotéine de 1278 résidus qui possède plusieurs domaines (Structural Insights into the Niemann-Pick C1 (NPC1)-Mediated Cholesterol Transfer and Ebola Infection 2016).
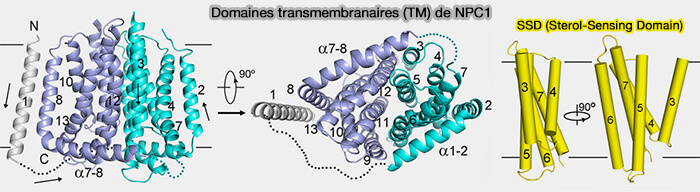
(Figure : vetopsy.fr d'après Gong et coll)
1. Les domaines transmembranaires sont au nombre de 13.
- TM2 et TM8 sont précédés par une longue hélice qui les lient à la membrane cellulaire.
- 2 RND (Resistance-Nodulation-cell Division superfamily fold) sont composés des TM3 à 7 et TM8 à 13 dans la structure de NCR1, l'homologue de NCP1 de Saccharomyces cerevisiae.
- Le SSD (Sterol-Sensing Domain), qui se lie au aux stérols, est localisé dans les TM3 à 7 comme dans d'autres protéines (
domaine SSD).
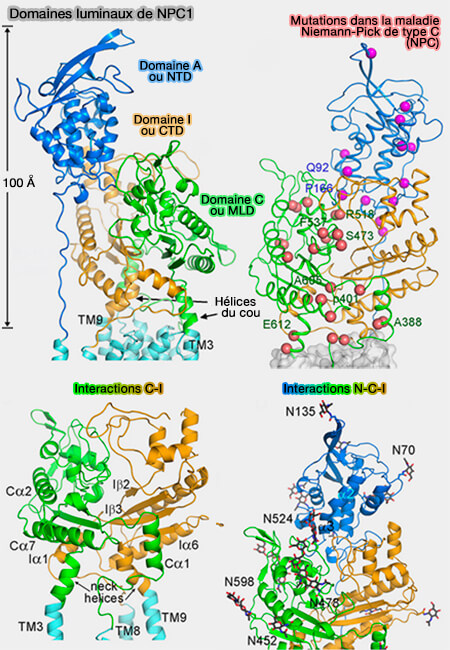
(Figure : vetopsy.fr d'après Gong et coll)
2. Les domaines luminaux, au nombre de 3, interagissent.
a. Le premier domaine luminal N-terminal (domaine A ou NTD) contient un site de liaison au cholestérol et s'étend dans le glycocalyx(Structure of N-Terminal Domain of NPC1 Reveals Distinct Subdomains for Binding and Transfer of Cholesterol 2009).
- Il est lié à TM1 par un domaine riche en proline 249PKPQPPPPPAP259.
- Il entre en contact avec le domaine C par un certain nombre de résidus, i.e. en particulier par l'hélice α3 du NTD, qui est enrichi de résidus polaires, mais peut-être aussi grâce les fragments de glucides attachés à Asn524 et Asn557 du domaine C.
Arg518 est engagé dans la liaison à NTD et ses mutations ponctuelles R518W ou R518Q sont liées à la maladie et ont entraîné une interaction réduite entre le domaine C isolé et NPC2.
b. Le deuxième domaine luminal (moyen) (domaine C ou MLD) se lie à NPC2.
- Deux boucles saillantes constituent l'interface de liaison prédominante entre ce domaine et NPC2.
- Le MLD entre en interaction avec TM2 par un lien étendu et se termine par une hélice dont l'extension forme TM3.
c. Le domaine I (ou CTD), se lie de la même manière que le domaine C, i.e. avec TM8 et l'extension de l'hélice forme TM9.
Les deux hélices du domaine C et I sont quelquefois appelées " hélices du cou " car elle peuvent représenter les éléments de couplage entre les domaines luminaux respectifs et les répétitions TMD en cas de changements conformationnels concertés (Coupling of remote alternating-access transport mechanisms for protons and substrates in the multidrug efflux pump AcrB 2014). .
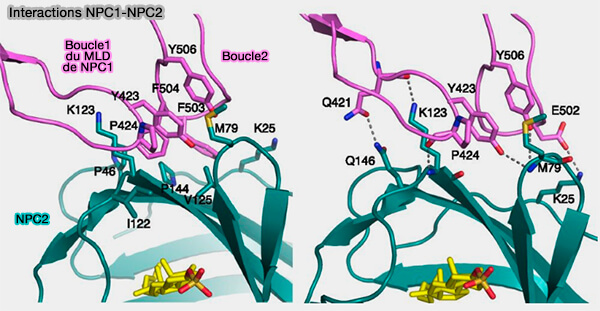
(Figure : vetopsy.fr d'après Li et coll)
3. Un tunnel dans la région MLD-CTD servirait de voie de transfert du cholestérol (Structural Basis for Cholesterol Transport-like Activity of the Hedgehog Receptor Patched 2018).
- Dans la structure NCR1/NPC2, le tunnel s'étend du feuillet de la membrane et du domaine SSD au motif 157-172 en hélice de boucle de NTD, qui est positionné sous l'embouchure du tunnel et semble le bloquer comme une porte.
- Dans le NTD, le site de liaison des stérols est une continuation directe de ce tunnel.
Remarque : la structure de NPC1L1 (Niemann-Pick C1-like 1), qui permet l'absorption du cholestérol ainsi que sa résorption biliaire et son acheminement vers le réticulum endoplasmique (RE) est comparable à celle de NPC1 (
Mécanisme de sortie du cholestérol

Nous ne détaillerons pas les mécanismes possibles qui sont envisagés sont développés dans : Structural Insight into Eukaryotic Sterol Transport through Niemann-Pick Type C Proteins (2019) et Structural Basis of Low-pH-Dependent Lysosomal Cholesterol Egress by NPC1 and NPC2 (2020).
1. Dans le lysosome, le cholestérol est libéré de sa lipoprotéine et est livré à la cavité hydrophobe de NPC2 (Structural Insights into the Niemann-Pick C1 (NPC1)-Mediated Cholesterol Transfer and Ebola Infection 2016).
Le NTD de NPC1, dans l'état de pré-chargement est prêt à recevoir un stérol.
2. NPC2, chargé de stérols, rappelons qu'il en contient 5 dans sa forme nonamérique, s'amarre au MLD et forme ainsi le complexe de chargement (Clues to the mechanism of cholesterol transfer from the structure of NPC1 middle lumenal domain bound to NPC2 2016)
Le stérol est transféré de NPC2 au NTD de NCP1.
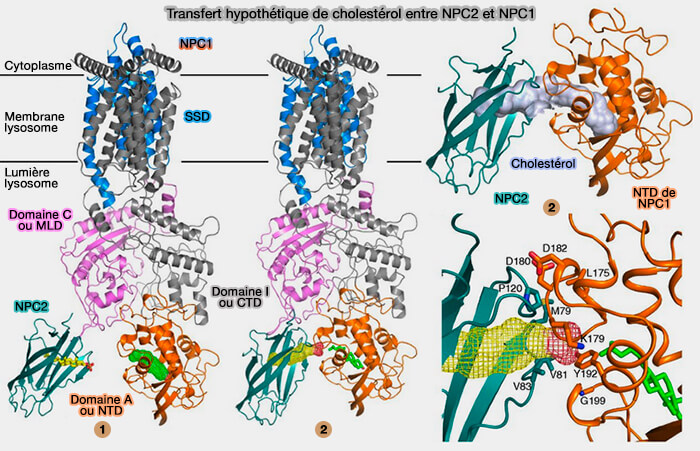
(Figure : vetopsy.fr d'après Li et coll)
3. Le NTD de NCP1, pivote de sorte que la poche de liaison s'aligne avec le tunnel, et le stérol est déplacé du NTD au tunnel (Structural Insight into Eukaryotic Sterol Transport through Niemann-Pick Type C Proteins 2019 et Structural Basis of Low-pH-Dependent Lysosomal Cholesterol Egress by NPC1 and NPC2 2020).
- Le stérol est transporté vers le SSD transmenbranaire pour traverser le glycocalyx lysosomal.
- Le stérol sort au niveau du SSD et se dissocie dans la bicouche lipidique.
La figure suivante est tirée de ces trois travaux.
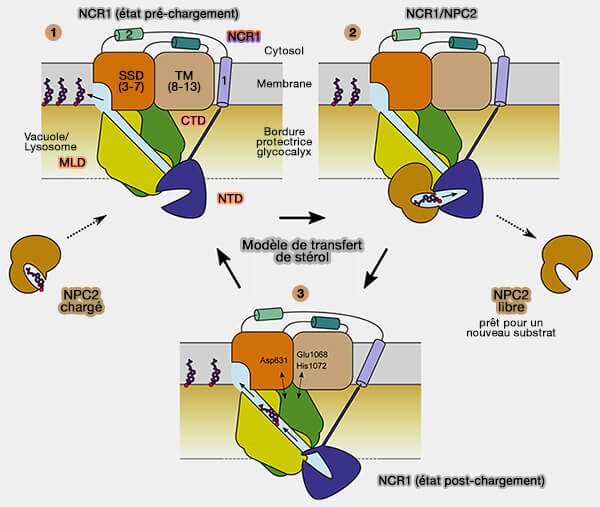
(Figure : vetopsy.fr d'après Winkler et coll)
4. Cette autre figure, à modèle légèrement différent pour ce qui est de la rotation du NTD, est tirée de Structural basis for itraconazole-mediated NPC1 inhibition (2020).
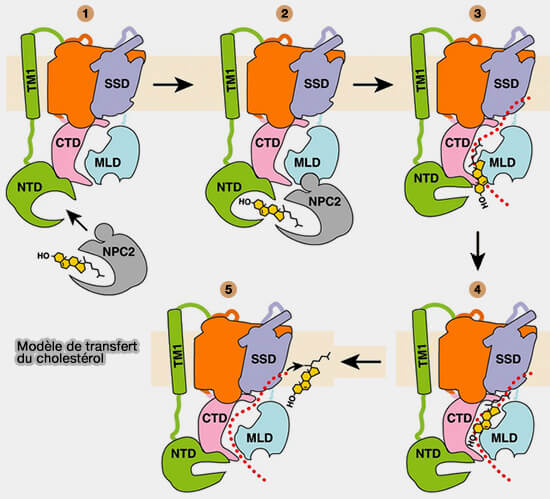
(Figure : vetopsy.fr d'après Long et coll)
Remarque 1 : la livraison du cholestérol alimentaire au NTD de NPC1L1 est médiée par la bile plutôt que par une protéine spécifique comme NPC2 (
En outre, si NPC1L1 peut circuler dans l'espace intracellulaire par endocytose, NPC1 est séquestré dans les lysosomes pour assurer le transport du cholestérol à travers la membrane lysosomale en route vers le réticulum endoplasmique (Structures of dimeric human NPC1L1 provide insight into mechanisms for cholesterol absorption 2021).
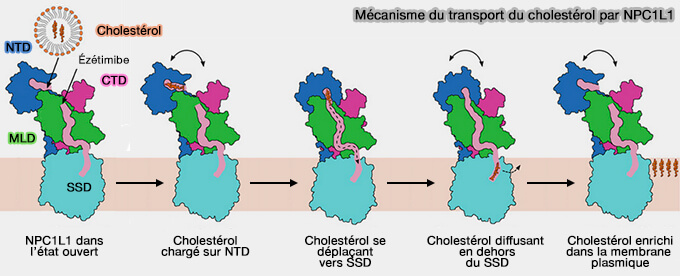
(Figure : vetopsy.fr d'après Huang et coll)
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolAcides biliairesGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


