Domaines protéiques
Domaine immunoglobuline (Ig)

Le domaine immunoglobuline est un type de domaine protéique qui se retrouve dans une superfamille appelée la superfamille des immunoglobulines (IgSF).
Les membres de cette superfamille sont impliqués dans un grand nombre de fonctions, comme :
- la motilité et la réorganisation du cytosquelette,
- la prolifération et la différenciation cellulaire, le développement neuronal,
- la réponse immunitaire.
Domaine Ig
Les domaines Ig comprennent 70 à 110 acides aminés et sont classés en fonction de leur taille et de la fonction (Ig-like domains: Evolution from simple interaction molecules to sophisticated antigen recognition 1999).
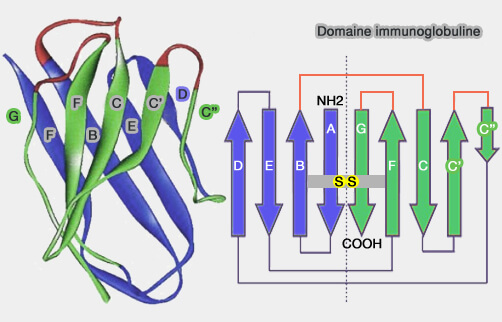
(Figure : vetopsy.fr)
1. Le domaine est formé de deux feuillets de brins β antiparallèles dont les interactions, qui stabilisent l'ensemble, sont sous-tendues par :
- des acides aminés hydrophobes,
- un ponts disulfure hautement conservé par les cystéines entre les brins B et F (The immunoglobulin fold. Structural classification, sequence patterns and common core 1994).
2. Les domaines de type Ig peuvent être classés en :
- domaines variables : IgV qui comptent 9 brins β ;
- domaines constants : IgC1 et IgC2, qui n'en comptent que 7 ;
Les IgC2 ont une structure primaine proche des IgV, mais sont de la taille des IGC.
- domaines intermédiaires ou IgI.
Remarque : des domaines à structure similaire sont appelés immunoglobuline-like comme, par exemple, le domaine ML (MD-2-related lipid-recognition) qui compte 7 brins β présents dans NPC2.
Récepteurs à domaine Ig
Ces récepteurs comprennent plusieurs régions.
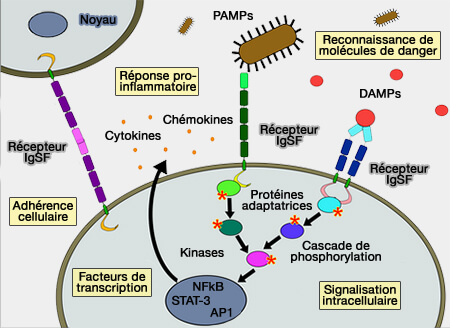
(Figure : vetopsy.fr d'après Laure Yatime)
1. La région extracellulaire contient en général différents domaines Ig.
- Le plus éloigné, qui est un domaine IgV, contient le site du récepteur aux ligands.
- Puis, on trouve des domaines IgC qui relient le récepteur à la membrane.
2. Les récepteurs à domaines Ig :
- présentent le plus souvent une seule hélice α transmembranaire,
- sont ancrés grâce à du glycosylphosphatidylinositol (GPI) à la membrane.
3. Le domaine intracellulaire est court et contient :
- soit des motifs de liaison pour des molécules qui interviennent dans la signalisation intracellulaire comme les kinases ou les protéines adaptatrices,
- soit des domaines de phosphorylation tridimensionnellement structurés.
Protéines à domaine Ig
Les protéines à domaine Ig comprennent :
- les récepteurs d'antigène de surface cellulaire,
- les co-récepteurs et les molécules de co-stimulation du système immunitaire,
- des molécules impliquées dans la présentation des antigènes aux lymphocytes,
- des molécules d'adhésion cellulaire, par leur propension à dimériser (cis et trans),
- certains récepteurs de cytokines et de protéines musculaires intracellulaires,
- les canaux sodium voltage-dépendants.
Izumo, protéine spécifique du sperme, seule protéine membranaire essentielle à la fusion du spermatozoïde/ovule, en fait aussi partie (The immunoglobulin superfamily protein Izumo is required for sperm to fuse with eggs 2005).
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


