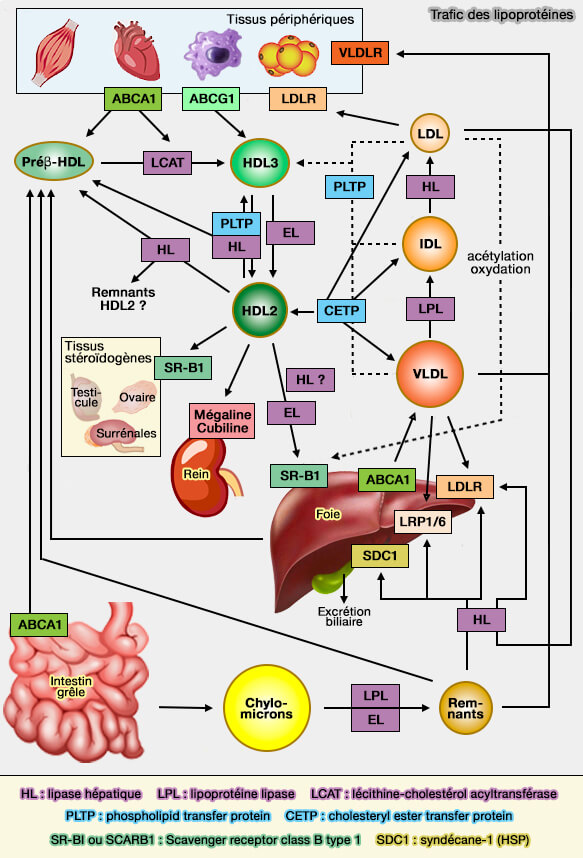
Transport des lipides
Lipoprotéines : récepteurs
Récepteurs LDLR : trafic
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les membres de la famille des LDLR (Low-Density Lipoprotein Receptor) sont impliqués, entre autres, dans le transport des lipoprotéines qui doivent à un certain stade de leur métabolisme, être endocytées.
(Figure : vetopsy.fr)
Étapes du trafic des LDLR
Le trafic des des lipoprotéines comprend plusieurs étapes, somme toute classiques (Low-Density Lipoprotein Internalization, Degradation and Receptor Recycling Along Membrane Contact Sites 2022).
1. Les lipoprotéines se lie aux LDLR par l'apoE ou l'apoB.
2. L'internalisation des LDLR dans des vésicules de clathrine, dépendant de PI(4,5)P2 ou PIP2, est classique (
3. Les lipoprotéines sont transportées vers les endosomes précoces où elles sont dissociées des LDLR par le pH acide (
Les lipoprotéines peuvent suivre deux voies :
- vers les endosomes de recyclage pour être transportés vers la membrane plasmique,
- vers les endosomes tardifs, i.e. pour les récepteurs qui ne parviennent pas à se séparer des LDL ou qui sont marqués pour la dégradation par des facteurs extracellulaires ou intracellulaires.
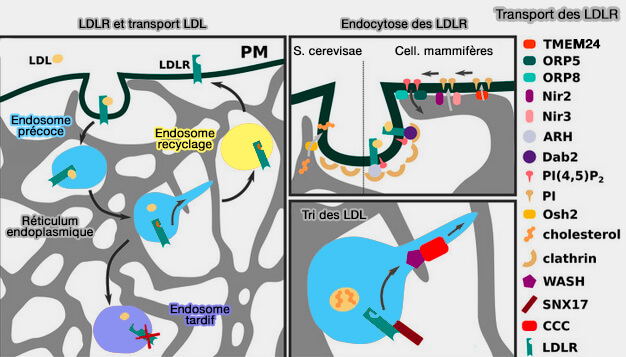
(Figure : vetopsy.fr d'après Islam et coll)
4. Les lipoprotéines sont hydrolysés dans les lysosomes, l'apoE est en général recyclée vers la membrane plasmique.
5. Les lipides, i.e. acides gras, cholestérol, sont libérés dans le cytoplasme pour servir :
- soit de combustible énergétique,
- soit mis en réserve dans des goutelettes lipidiques (LD ou Lipid Droplet).

La clairance des lipoprotéines et son défaut, i.e. leur accumulation, en particulier des LDL (lipoprotéines de basse densité), est une cause majeure d'hyperlipidémie familiale et un facteur de risque fondamental pour les maladies cardiovasculaires (
Dissociation du complexe ligand-LDLR au niveau endosomal
1. La dissociation du complexe ligand-récepteur s'effectue au niveau endosomal et est dépendante du pH, i.e. la conformation du LDLR passe d'une conformation ouverte, i.e. ligand-actif à une conformation fermée, i.e. ligand-inactif (Structure of the LDL Receptor Extracellular Domain at Endosomal pH 2002).
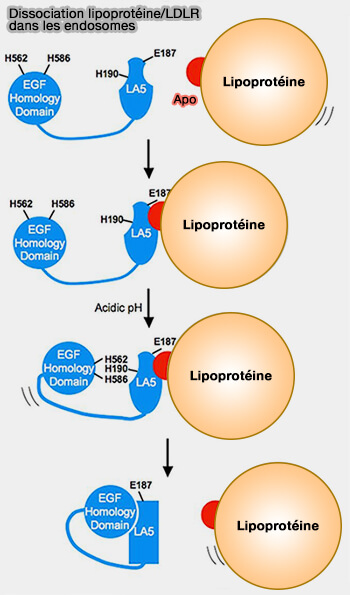
(Figure : vetopsy.fr d'après Zhao et coll)
La stabilité de LR5 diminue considérablement en raison de la diminution du pH et des concentrations de Ca++ dans l'endosome, déclenchant ainsi le déploiement de LR5 et par conséquent la libération de LDL (lipoprotéines de basse densité) par le récepteur.
2. Le mécanisme sous-jacent à ce changement de conformation est encore obscur.
a. Soit trois résidus d'histidine situés à l'interface entre la cinquième répétition du domaine de liaison au ligand (LR5) et le β-propeller agissent comme des capteurs de pH qui permettent la flexion nécessaire du LDLR pour un changement conformationnel ultérieur (Mechanism of low density lipoprotein (LDL) release in the endosome: implications of the stability and Ca2+ affinity of the fifth binding module of the LDL receptor 2008).
b. Soit dans les endosomes, le β-propeller déplace le ligand lipoprotéique lié, agissant ainsi comme un substrat alternatif pour le domaine de liaison au ligand (The Epidermal Growth Factor Homology Domain of the LDL Receptor Drives Lipoprotein Release through an Allosteric Mechanism Involving H190, H562, and H586 2008).
- Lors de l'acidification, EGFPD contacte LR5, ce qui entraîne un changement conformationnel dans LR5 qui implique H190, H562 et H586.
- Le changement conformationnel de LR5 perturbe les sites de liaison des apolipoprotéines, entraînant ainsi la libération.
3. En outre la liaison dépend de l'apolipoprotéine en cause (
Retour aux LDLR
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasPhospholipidesPhosphoinositidesCholestérolAcides biliairesGlycéridesDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesTrafic des lipoprotéinesRécepteurs des lipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


