Transport des lipides : lipoprotéines
Apolipoprotéines
ApoB : apoB-48 et apoB-100
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
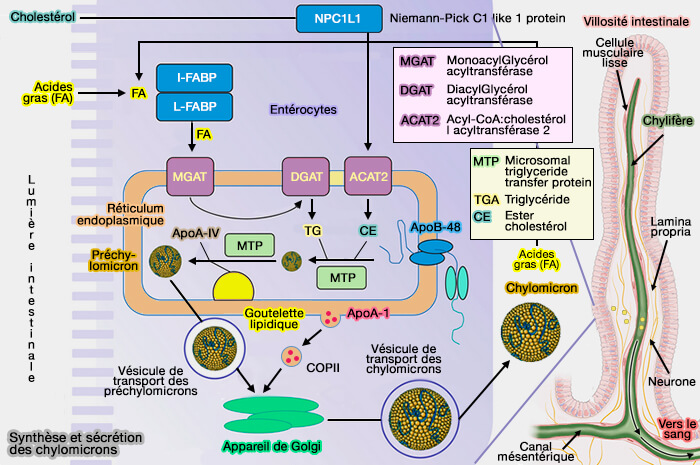
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les apolipoprotéines B (apoB), synthétisés dans l'intestin pour l'apoB-48 et dans le foie pour apoB-100, sont responsables du transport des lipides dont le cholestérol, dans tout le corps vers toutes les cellules de tous les tissus.
Vue d'ensemble des apoB
1. L'apolipoprotéine B est la principale apolipoprotéine :
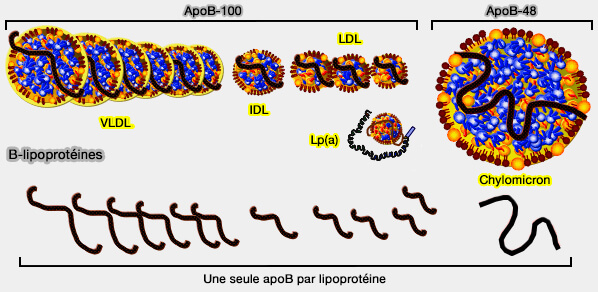
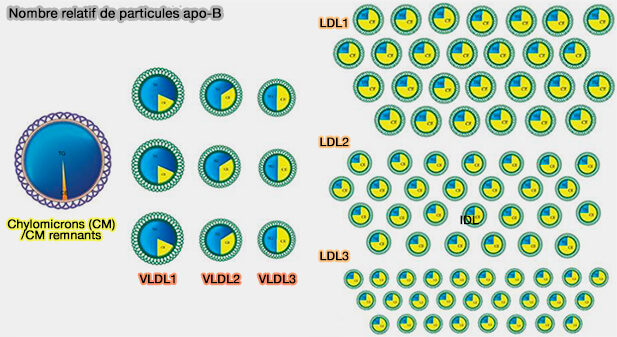
- des chylomicrons et des VLDL (lipoprotéines de très basse densité), appelés TRL (lipoprotéines riches en triglycérides), ainsi que leurs remnants,
- des IDL (lipoprotéines de densité intermédiaire),
- des LDL (lipoprotéines de basse densité), communément appelées " mauvais cholestérol " en référence à leur rôle dans les maladies vasculaires et cardiaques,
- de la lipoprotéine (a) ou Lp(a), une lipoprotéine de densité et de dimensions similaires aux LDL, dans laquelle l'apoB est liée de manière covalente à l'apo(a).
(Figure : vetopsy.fr)
2. L'apoB est présente sur toutes les lipoprotéines, excepté les HDL (lipoprotéines de haute densité) :
- l'apoB-48 sur les chylomicrons,
- l'apoB-100 sur les autres.
Remarque : les B-lps sont les lipoprotéines qui contiennent de l'apoB.
ApoB-100 et apoB-48
Le gène APOB humain est situé sur le chromosome 2 (
1. Dans le foie, APOB produit de l'apoB-100, ou apoB pleine longueur, i.e. 4136 résidus, car Apobec-1 n'est pas exprimée (sauf chez les rats et les souris).
ApoB-100 est utilisée dans la formation des VLDL (lipoprotéines de très basse densité) pour transporter les lipides synthétisés par le foie vers les tissus périphériques (
2. Dans l'intestin grêle, l'apoB-100 peut être modifié post-transcriptionnellement par Apobec1 (Apolipoprotein B mRNA editing enzyme, catalytic polypeptide-like complex-1) qui produit une apoB tronquée appelée apoB-48, i.e. 2143 résidus (ApoB48 as an Efficient Regulator of Intestinal Lipid Transport 2020).
- L'enzyme transforme une cytidine spécifique, i.e. cytidine 6666, en uridine par désamination hydrolytique et introduit un codon d'arrêt.
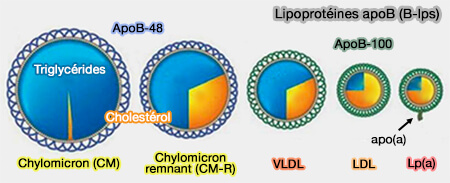
- L'apoB-48 est spécifique des chylomicrons (CM) et de ses remnants (CM-R).
- L'apoB-48 ne contient pas la région de liaison au LDLR (Low-Density Lipoprotein Receptor) de l'apoB, qui est excisée par un mécanisme distinctif d'édition de l'ARN spécifique à l'intestin.
3. L'apoB-100 et l'apo-B48 sont des composants structuraux essentiels des particules d'apoB et sont présentes tout au long de leur vie dans le plasma.
Comme chaque particule ne possède qu'une molécule d'apoB, l'apoB plasmatique total est une mesure exacte du nombre total de particules d'apoB dans le plasma.
(Figure : vetopsy.fr d'après Attia)

L'assemblage des lipoprotéines commence en même temps que la traduction de l'ARNm de l'apoB, aussi bien dans l'intestin que dans le foie, pour servir au transport des lipides (
4. L'assemblage cotraductionnel dépend de deux paramètres (Lipid transfer proteins in the assembly of apoB-containing lipoproteins 2018).
(Figure : vetopsy.fr d'après Glavinovic et coll)
a. Des lipides doivent être disponibles (Apolipoprotein B100 biogenesis: a complex array of intracellular mechanisms regulating folding, stability, and lipoprotein assembly 2009) :
- soit par synthèse dans la membrane du réticulum endoplasmique (
resynthèse des lipides),
- soit par mobilisation des lipides des goutelettes lipidiques (LD ou Lipid Droplet).
b. La présence du chaperon MTTP (Microsomal Triglyceride Transfer Protein) est indispensable, i.e. en son absence, l'apoB associée à la membrane subit une dégradation protéosomale (The degradation of apolipoprotein B100: multiple opportunities to regulate VLDL triglyceride production by different proteolytic pathways 2012).
(Figure : vetopsy.fr d'après Glavinovic et coll)
Structure des apoB

La structure des apoB est complexe et loin d'être élucidée à l'heure actuelle.
1. Nous n'entrerons pas dans les détails et vous pouvez vous reporter aux articles suivants, dont le premier et le plus ancien fait encore plus ou moins consensus :
- Structure of apolipoprotein B-100 in low density lipoproteins (2001),
- A New Structural Model of Apolipoprotein B100 Based on Computational Modeling and Cross Linking (2022),
- Computational studies of plasma lipoprotein lipids (2016),
- Nonsynonymous Mutations within APOB in Human Familial Hypobetalipoproteinemia (2010),
- Modular structure of solubilized human apolipoprotein B-100 - Low resolution model revealed by small angle neutron scattering (2006).
2. L'apoB-100, qui est la plus étudiée, comprend 5 sous-unités représentées sur la figure ci-dessous :
- la sous-unité I (résidus 28-1017), βα1,
- la sous-unité II (résidus 1018-2072), β1,
- la sous-unité III (résidus 2073-2550), α2,
- la sous-unité IV (résidus 2551-4057), β2,
- la sous-unité V (résidus 4058-4563), α3.
3. Les apoB sont glycosylées (The known unknowns of apolipoprotein glycosylation in health and disease 2022).
- L'apoB-100 contient 19 sites potentiels de N-glycosylation dont 17 sites sont glycosylés.
- Dans ApoB-48, cinq des six sites de N-glycosylation prédits sont glycosylés.
4. L'apoB s'enroulent autour de la lipoprotéine et ne fait pas partie des apolipoprotéines échangeables.
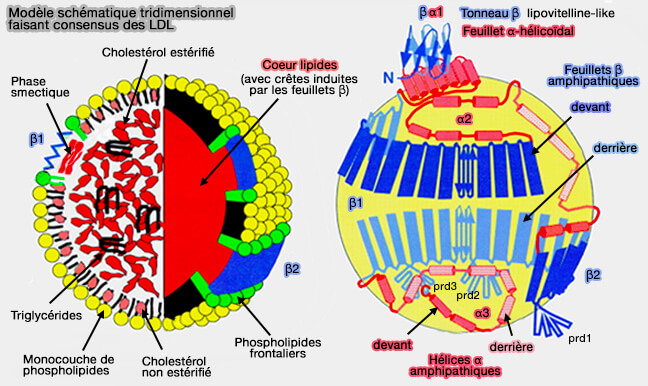
(Figure : vetopsy.fr d'après Segrest et coll)
Protéines impliquées dans la lipidation des apoB
La lipidation des apoB s'effectue en deux étapes.
1. Dans la première étape, une petite quantité de lipides est transférée à l'apoB naissante lors de la translocation dans la lumière du réticulum endoplasmique (RE), formant une particule apoB primordiale, grâce à la MTTP (Microsomal Triglyceride Transfer Protein), abrégé aussi en MTP (
Une fonction MTTP défectueuse ou manquante entraîne une A-bêta-lipoprotéinémie (syndrome de Bassen-Kornzweig), une maladie autosomique récessive rare.
2. Au cours de la deuxième étape, i.e. expansion du coeur, des lipides sont ajoutés à la particule apoB primordiale après la traduction (
Remarque : d'autres protéines comme PLTP (PhosphoLipid Transfer Protein), CIDEB (Cell Death-Inducing DFF45-like Effector B) ou CGI-58 (ABHD5) interviennent aussi dans la lipidation (

Toutes ces protéines sont étudiées dans des chapitres spécifiques.
Processus d'assemblage de la particule d'apoB primordiale
Dans vetopsy.fr, nous développons la formation des chylomicrons, i.e. nous vous renvoyons à la phase 3 de la formation de la particule apoB primordiale dans le réticulum endoplasmique (RE) des entérocytes.
Le processus est à peu près identique dans la formation des VLDL (lipoprotéines de très basse densité) par les hépatocytes.
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


