Transport des lipides
Lipoprotéines
Lipoprotéine(a) ou Lp(a)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La lipoprotéine(a), i.e. Lp(a), est une classe de lipoprotéine qui se forme exclusivement dans le foie, et comprend deux composants principaux, une apoB-100 et une apo(a).
Vue d'ensemble de la LP(a)
La Lp(a) présente les mêmes caractéristiques, i.e. composition, caractéristiques physiques et chimiques que les LDL (lipoprotéines de basse densité).
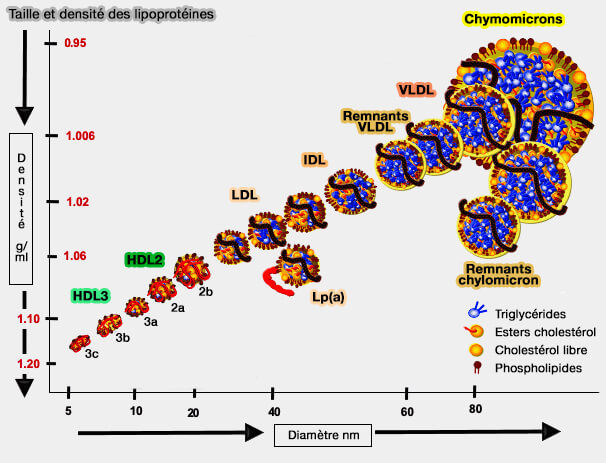
(Figure : vetopsy.fr d'après Attia)
1. la Lp(a) a un composant hydrophile avec une seule molécule d'apoB-100 situé autour d'un noyau lipidique d'esters de cholestérol (CE) et de triglycérides (TG) avec de nombreux phospholipides (PL) et du cholestérol libre (FC) à sa surface (Lipoprotein (a) measurements for clinical application 2016).
.jpg)
(Figure : vetopsy.fr d'après Jawi et coll)
2. La Lp(a) se distingue de LDL par sa partie apo(a) hydrophile hautement glycosylée, i.e. le composant pathogène de type plasminogène (PLG) de la Lp(a) (A Test in Context: Lipoprotein(a): Diagnosis, Prognosis, Controversies, and Emerging Therapies 2017).
- Apo(a) est le composant clé de la Lp(a) et a évolué à partir de la superfamille des gènes PLG il y a très longtemps par duplication et remodelage.
- L'existence de l'apo(a) confère des caractéristiques synthétiques, cataboliques et fonctionnelles distinctives ainsi qu'une énorme hétérogénéité de taille.
Structure de l'apo(a)
Structure générale
La structure de l'apo(a) comprend de multiples domaines.
1. Les domaines kringle, dont le nom est tiré de sa forme ressemblant à une pâtisserie scandinave, sorte de bretzel, sont formé de 80 résidus et possèdent chacun six résidus de cystéine conservés qui forment trois pont disulfure pour fournir la structure à triple boucle caractéristique des kringles (Identification and analyses of inhibitors targeting apolipoprotein(a) kringle domains KIV-7, KIV-10, and KV provide insight into kringle domain function 2020) :
a. On trouve 10 sous-types de répétitions de KIV (kringle IV, i.e de type 4), composés :
- d'une copie de KIV1,
- de multiples copies de KIV2, i.e. 4 à 40 selon les isoformes,
- d'une copie de KIV3 à KIV10, mais pas les KI, II et III de PLG,
b. un seul KV (Kringle V, i.e. de type 5) est localisé avant le domaine protéase.
Remarque : les domaines kringle sont aussi retrouvés, outre le plasminogène et ses activateurs, dans l'urokinase et la prothrombine (Structure, function, and genetics of lipoprotein (a) (2016).
2. Le domaine de type protéase est inactif, contrairement à PLG.
-kringle.jpg)
(Figure : vetopsy.fr d'après Sandmark et coll)
Fonction des différents domaines
1. L'apoB possède une cystéine non appariée (Cys-3734) qui forme le seul pont disulfure avec la cystéine isolée de KIV9 de Lp(a).
2. Des liaisons à la lysine sont essentielles à la création du complexe apo(a)-LDL par :
- KIV10,
- KIV7-8 avec de faibles sites de liaison de la lysine (LBS) entre les kringle et qui permettent la création du pont disulfure précédent.
3. KIV6-7 interagissent avec les récepteurs des cellules spumeuses (Lipoprotein(a): A Promising Marker for Residual Cardiovascular Risk Assessment 2013).
Cette interaction entraîne la sécrétion de cytokines pro-inflammatoires, telles que les interleukines (IL1 et IL-6) et les métalloprotéinases matricielles (MMP), qui peuvent amplifier la réponse inflammatoire locale et stimuler la prolifération et la migration initiale des cellules musculaires lisses vasculaires (CMLV). vers la lésion athéroscléreuse.
4. Les phospholipides oxydés (OxPL) présents dans les OxLDL (
Métabolisme supposé de la Lp(a)

Le métabolisme supposé de la Lp(a) est détaillé dans : Lipoprotein(a) the Insurgent: A New Insight into the Structure, Function, Metabolism, Pathogenicity, and Medications Affecting Lipoprotein(a) Molecule (2020).
La numérotation correspond à la figure ci-dessous tiré du même article.
1. La production de Lp(a) (au niveau du foie nécessiterait cinq étapes :
- la transcription du gène apo(a) et la stabilité de l'ARNm de l'apo(a) dans le noyau,
- l'influence de la traduction de l'apo(a) sur le taux de production,
- des modifications post-traductionnelles et le repliement des kringles de apo(a) dans le réticulum endoplasmique (RE),
- l'ajout et des modifications spécifiques de Golgi des glucides de l'apo(a) par l'appareil de Golgi
- le transport vers la surface cellulaire.
2. Le site d'assemblage de la Lp(a) est controversé et pourrait être soit la surface cellulaire, soit l'espace de Disse, soit le plasma.
-metabolisme.jpg)
(Figure : vetopsy.fr d'après Jawi et coll)
3. L'apo(a) s'associe à une lipoprotéine récemment synthétisée et riche en triglycérides (TG) pour former la Lp(a) aux propriétés VLDL (lipoprotéines de très basse densité) et/ou à une molécule abondante en cholestérol aux propriétés LDL (lipoprotéines de basse densité).
4. La Lp(a) riche en TG peut être transformée en une molécule riche en cholestérol aux propriétés LDL.
5. Les Lp(a) peuvent suivre plusieurs voies différentes par sépararation de ces deux composants, i.e. la génération de fragments d'apo(a) provient très probablement d'un clivage protéolytique par des élastases ou des métalloprotéinases matricielles (MPP) sécrétées par des cellules de la paroi artérielle.
a. L'apo(a) peut rejoindre son pool récemment produit par les hépatocytes.
b. La lipoprotéine est internalisée et absorbée :
- soit par les hépatocytes par différents récepteurs, i.e. LRP2/megaline, récepteur gp330, SR-BI, LRP1, VLDLR, le récepteur PLGRKT, le récepteur de l'asialoglycoprotéine (ASGPR),
- soit par les cellules rénales.
c. La lipoprotéine et l'apo(a) peuvent se déposer sur la paroi vasculaire.
Fonctions de la Lp(a) des lipoprotéines
La Lp(a) est génétiquement programmée et augmente le risque de maladie cardiovasculaire (infarctus, AVC) et d'athérosclérose (A Test in Context: Lipoprotein(a): Diagnosis, Prognosis, Controversies, and Emerging Therapies 2017).
- Un taux de Lp(a) >300 mg/L contribue à ces risques.
- Son rôle est encore mal compris (Lipoprotein(a) and its role in inflammation, atherosclerosis and malignancies 2017).
-pathogenie.jpg)
(Figure : vetopsy.fr d'après Tsimikas)

Vous pouvez étudier les différentes théories impliquant la Lp(a) pour provoquer l'athérosclerose : Lipoprotein(a) the Insurgent: A New Insight into the Structure, Function, Metabolism, Pathogenicity, and Medications Affecting Lipoprotein(a) Molecule (2020).
Retour aux lipoprotéines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


