Trafic vésiculaire
Endocytose clathrine-indépendante (CIE) à grande échelle
Phagocytose : fermeture du phagosome
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires : trafic vésiculaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Lors de la phagocytose, la fermeture du phagosome par la fusion des replis membranaires à l'extrémité distale ferme le phagosome et nécessite PI3KC, une kinase PI3K, et PI(3,4,5)P3.
Après la vue d'ensemble sur la phagocytose, étudions-en le mécanisme :
- 1. Détection de la particule par sondage (probing), i.e. voir aussi récepteurs phagocytaires
- 2. Initiation de la phagocytose : segmentation du réseau d'actine et mobilité des récepteurs phagocytaires
- 3. Formation de pseudopodes : nucléation et ramification de l'actine
- 4. Fermeture du phagosome
- 5. Maturation du phagosome

Nous décrirons les éléments essentiels de la phagocytose sans trop entrer dans les détails. La grande partie de ce chapitre est tirée de l'article : Phagocytosis: Our Current Understanding of a Universal Biological Process (2020) et Diffusion Barriers, Mechanical Forces, and the Biophysics of Phagocytosis (2016).
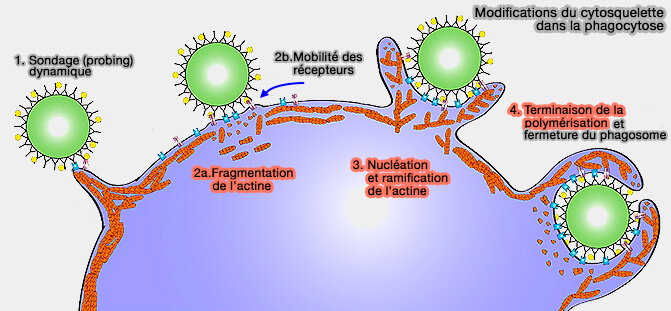
(Figure : vetopsy.fr d'après Thottacherry et coll)
4. Fermeture du phagosome
La fusion des replis membranaires à l'extrémité distale ferme le phagosome et nécessite PI3KC, une kinase PI3K, et PI(3,4,5)P3 :
- pour réduire la densité d'actine,
- pour recruter les myosines.
Réduction de la densité d'actine
La réduction d'actine à la base de la cupule phagocytaire permet la fusion des vésicules avec la membrane plasmique.
1. Avant la fermeture du phagosome, l'actine-F est réduite drastiquement de la base de la cupule phagocytaire, i.e. processus appelé clairance ou cleareance de l'actine (The NF-κB Signaling Protein Bcl10 Regulates Actin Dynamics by Controlling AP1 and OCRL-Bearing Vesicles 2012).
Les kinases de la famille Src (SFK) s'inactivent, arrêtant la signalisation qui soutient la polymérisation de l'actine, et les petites GTPases de la famille Rho hydrolysent le GTP qui maintient leur état actif.
La densité de l'actine-F à la base du phagosome naissant devient extrêmement faible, sensiblement inférieure à celle des zones de repos non engagées du squelette cortical.
- Lorsqu'une particule est engloutie, les réseaux denses d'actine-F qui ont permis l'adhésion des macrophages et la résistance à la traction peuvent entraver le développement de la courbure nécessaire de la membrane autour de la particule.
- L'apport de cette réserve membranaire par exocytose est nécessaire pour soulager la tension et permettre l'expansion de la cupule phagocytaire (Plasma membrane tension orchestrates membrane trafficking, cytoskeletal remodeling, and biochemical signaling during phagocytosis 2013 et A TRP Channel in the Lysosome Regulates Large Particle Phagocytosis via Focal Exocytosis 2013).
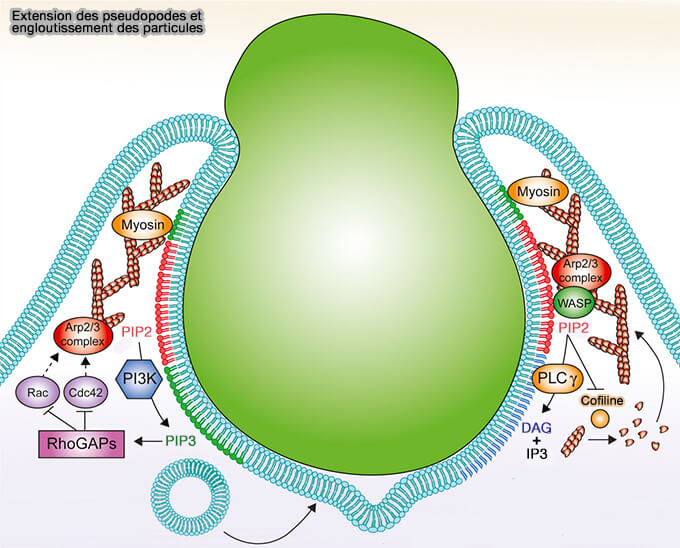
(Figure : vetopsy.fr d'après Ostrowski et coll)
2. Le mécanisme d'élimination de l'actine-F implique l'arrêt de la polymérisation de l'actine et la détachement et la dépolymérisation des filaments existants, tous deux contrôlés par PI3KC, une kinase PI3K, qui convertit PI(4,5)P2 en PI(3,4,5)P3 (A Requirement for Phosphatidylinositol 3-Kinase in Pseudopod Extension 1999).
1. PI(3,4,5)P3 recrute des GAP (GTPase-Activating Protein ou GTPase-Accelerating Protein) de la famille Rho qui provoquent la désactivation des GTPases Rac1 et Cdc42, nécessaires pour stimuler le complexe Arp2/3, et qui mettent fin à la polymérisation de l'actine à partir de la base de la cupule phagocytaire (A Cdc42 Activation Cycle Coordinated by PI 3-Kinase during Fc Receptor-mediated Phagocytosis 2010).
Les GAP ARHGAP12, ARHGAP25 et SH3BP1, qui contiennent des domaines PH qui se lient à PI(3,4,5)P3, s'accumulent dans la membrane phagosomale au moment où l'actine se dépolymérise (Phosphoinositide 3-kinase enables phagocytosis of large particles by terminating actin assembly through Rac/Cdc42 GTPase-activating proteins 2015).
2. Simultanément, PLCγ (PhosphoLipase C gamma) clive PI(4,5)P2 en DAG (DiAcylGlycérol) et en IP3 (Inositol 1,4,5- triphosphate).
a. Le feuillet interne de la membrane devient moins chargé négativement et les protéines qui s'associent électrostatiquement à la membrane, dont notamment Rac1, se dissocient plus facilement.
b. La perte de PI(4,5)P2 :
- provoque la dissociation et l'inactivation de WASP, de l'ezrine et de la taline, tous recrutés sur la membrane plasmique par les interactions avec PI(4,5)P2,
- libère la cofiline et la gelsoline pour fragmenter les filaments.
Recrutement des myosines
PI(3,4,5)P3 recruterait les myosines II qui exerceraient une activité contractile qui fonctionne un peu comme un lacet d'une bourse pour faciliter la fermeture du phagosome (Myosins: domain organisation, motor properties, physiological roles and cellular functions 2016 et Squeezing in a meal: myosin functions in phagocytosis 2020).

Le rôle des myosines II est encore controversé.
1. Les cellules de mammifères contiennent trois isoformes de myosine II non musculaires, i.e. NM2A/B/C (Nonmuscle myosin-2 isoforms 2019 et Distinct roles of nonmuscle myosin II isoforms for establishing tension and elasticity during cell morphodynamics 2021).
a. NM2A est l'isoforme dominante de la myosine II exprimée dans les cellules immunitaires (The myosin family: unconventional roles of actin-dependent molecular motors in immune cells 2011 et Nonmuscle myosin-2: mix and match 2012)
- Les myosines II (
structure des myosines II) s'assemblent en filaments ou minifilaments, structures bipolaires contenant des domaines moteurs de myosine à chaque extrémité du filament.
- Elles réticulent et contractent les filaments d'actine en favorisant le glissement des filaments d'actine les uns par rapport aux autres (
liaison de la myosine II à l'actine).
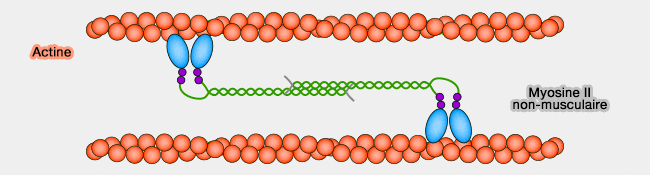
(Figure : vetopsy.fr)
b. NM2A est régulée par (Ca2+ Sensitivity of Smooth Muscle and Nonmuscle Myosin II: Modulated by G Proteins, Kinases, and Myosin Phosphatase 2003) :
- la phosphorylation réversible des chaînes légères régulatrices (RLC) par plusieurs kinases, i.e. MLCK (Myosin Light-Chain Kinase) et ROCK (Rho-associated Coiled-coil containing or forming Kinase),
- la déphosphorylation par l'activité de la MLCP (Myosin Light-Chain Kinase) par ROCK et d'autres régulateurs.
2. La phosphorylation des RLC augmente non seulement l'activité ATPase du moteur, mais facilite également l'assemblage des filaments de myosine II.
a. NM2A pourrait contribuer à l'internalisation des particules via la constriction de la coupe phagocytaire avec des résultats différents selon le type de cellule, le type de phagocytose (à médiation FcR ou CR)…
- Il semble probable que la myosine II génère une force contractile dans la cupule phagocytaire pendant l'internalisation pour favoriser une fermeture efficace, sans savoir encore comment les filaments d'actine sont structurés dans la cupule phagocytaire.
- Typiquement, les assemblages d'actine subcellulaire soumis à la contraction médiée par la myosine II sont composés d'actine-F de polarité opposée avec des degrés variables d'alignement des filaments d'actine et de myosine-II, mais on ne sait pas si ces assemblages sont présents dans les cupules phagocytaires (Mammalian Nonmuscle Myosin II Comes in Three Flavors 2019).
b. Pour que la myosine II agisse efficacement sur de tels filaments, ces faisceaux d'actine-F doivent être immobilisés, i.e. ancrés à la membrane ou réticulés les uns aux autres.
Ce rôle pourrait être tenu par l'alpha-actinine qui a été localisée dans la coupe phagocytaire.
3. À l'avenir, il sera important de déterminer où et dans quelle direction la force générée par la myosine II est appliquée dans la cupule (Myosin IIA interacts with the spectrin-actin membrane skeleton to control red blood cell membrane curvature and deformability 2018).
5. Maturation du phagosome
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


