Domaines protéiques
Domaines
d'interaction membranaire
Domaine PH (Pleckstrin homology domain)

Le domaine PH (Pleckstrin Homology Domain) est un domaine protéique d'environ 120 acides aminés de nombreuses protéines impliquées dans la signalisation intracellulaire ou la constitution du cytosquelette.
Ce domaine a d'abord été découvert en deux exemplaires dans la pleckstrine, substrat majeur de la protéine kinase C (PKC) dans les plaquettes, d'où son appellation.
Structure du domaine PH

Pour en savoir plus sur le domaine PH : Pleckstrin homology (PH) like domains – versatile modules in protein–protein interaction platforms (2012).
1. La structure du domaine PH comprend (Solution structure of a pleckstrin - homology domain 1993) :
- un feuillet β (β-sheet) N-terminal à quatre brins (β-strand),
- un feuillet β antiparallèle à trois brins qui comporte une hélice α C-terminale amphipathique.
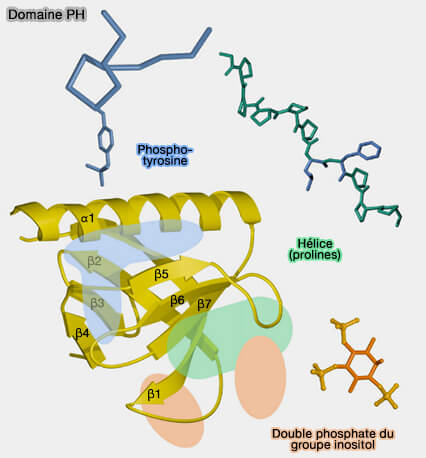
(Figure : vetopsy.fr d'après Sudol et coll)
Les sept segments β sont séparés par des boucles et l’ensemble est replié sur lui-même en deux feuillets sensiblement orthogonaux formant un " sandwich " fermé par l’hélice α.
- Des boucles courtes conservées connectent les brins β2 à β3, β4 à β5 et β7 à l’hélice α.
- Les autres boucles ont des structures variables.
- Un tryptophane (W), hautement conservé, est situé au début ou au milieu de l'hélice α et joue un rôle essentiel dans la liaison entre les feuillets β et cette hélice.
2. Une des caractéristiques du domaine PH, qui est rarement retrouvée dans d'autres domaines, est d'être polarisé (The PH superfold: a structural scaffold for multiple functions 1999).
- La région à potentiel positif est localisée du côté opposé à celui de l’hélice α et inclut la surface des boucles ayant les séquences les plus variables, en particulier β1-β2 et β5- β6.
- Ce potentiel positif est dû à des lysines et des arginines conservées dans les divers domaines PH.
a. Cette propriété permet de se lier facilement à certains phospholipides membranaires (potentiel négatif), et en particulier aux phosphoinositides, qui comportent deux phosphates adjacents au groupe inositol (phosphatidylinositol bisphosphates) comme le PI(4,5)P2 ou le PI(3,4)P2 de la membrane (Pleckstrin Homology (PH) domains and phosphoinositides 2007).
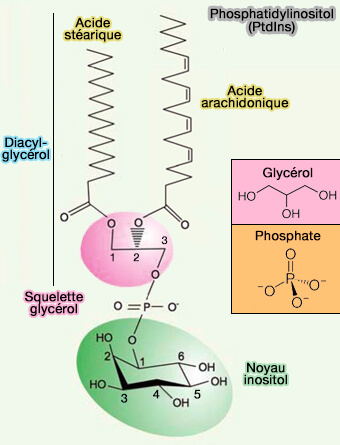
(Figure : vetopsy.fr)
- Le domaine PH se lie aussi au PI(3,4,5)P3.
- Les phosphoinositolipides qui ne comportent qu'un groupe phosphate (phosphatidylinositol monophosphates) sont au contraire reconnus par des classes distinctes de domaines comme les domaines FYVE et les domaines PHD proches des domaines RING, PX et PROPPIN (β-propellers that bind polyphosphoinositides) qui jouent un rôle essentiel dans l'autophagie.
b. Cette particularité est essentielle, car la régulation du recrutement du domaine PH est sous le contrôle des kinases/phosphorylases qui phosphorylent/déphosphorylent l'anneau inositol.
- Les phosphoinositides 3-kinases jouent un rôle majeur dans de nombreux processus comme la croissance cellulaire, la prolifération, la différenciation, la motilité, la survie et le trafic intracellulaire.
- PTEN (Phosphatase and Tensin Homolog) produit du PIP2 à partir de la déphosphorylation du PIP3, déphosphorylation essentielle dans l'inhibition de la voie de signalisation AKT.
Remarque : le domaine GRAM, proche du domaine PH, est localisé dans les membres de la famille GRAMD/Lam qui joue un rôle dans les sites de contact membranaire (MCS) RE/MP.
Liaisons à des partenaires protéiques
Excepté sa liaison avec les phospholipides membranaires, le domaine PH peut se lier à de nombreux partenaires protidiques (
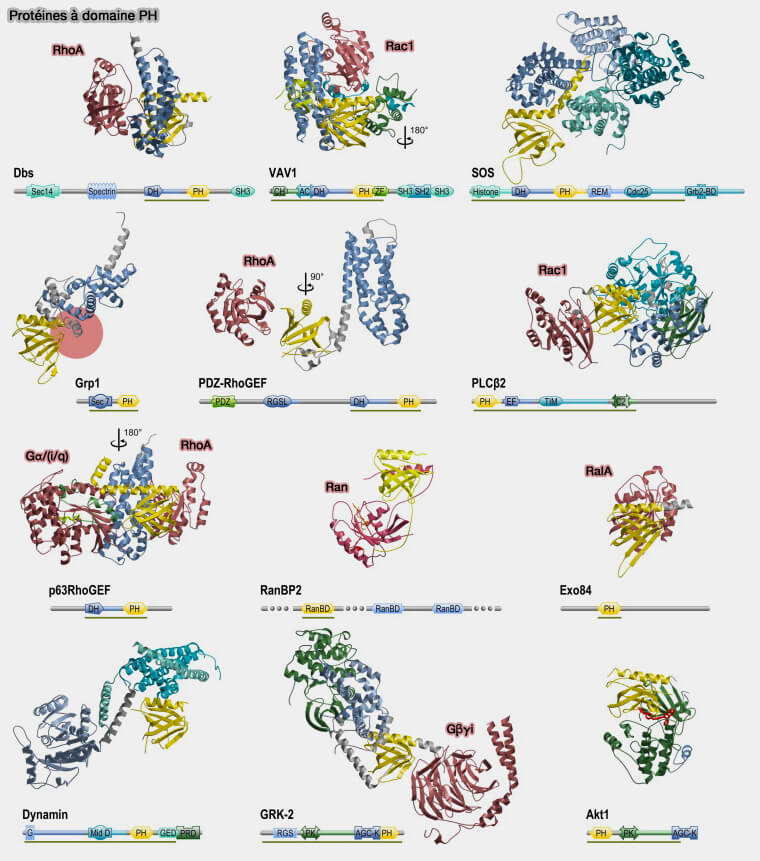
(Figure : svetopsy.fr d'après Sudol et coll)
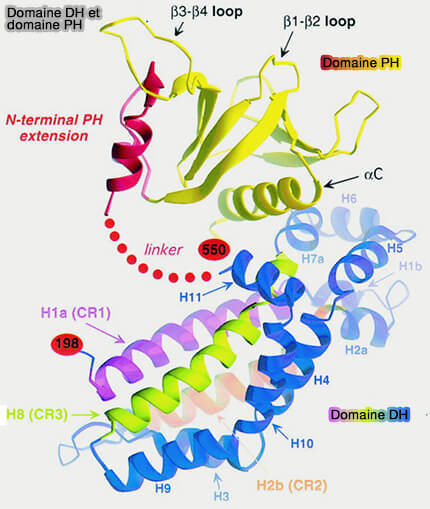
1. Les GEF (Guanine nucleotide Exchange Factors) de la famille Rho contiennent typiquement un domaine DH (Dbl Homology) suivi par un domaine PH (
Son rôle n'est pas bien compris : il formerait un module avec le domaine DH (
2. Un nombre important de composantes de transduction de signal ou de régulation de signal sont directement contrôlées via les les sous-unités βγ des protéines G activées (GGNBP : Guanine Nucleotide Binding Proteins), protéines dans lesquelles le domaine PH sert de plate-forme d'interaction protéine-protéine pour accueillir l'activateur de la protéine G, comme :
- la phospholipase C-β2/γ2, activée par les membres de la famille Rho,
- le complexe Gαq-p63RhoGEF-RhoA, signalisation régulée par le couplage Gα/Rho,
- le domaine de liaison RAN (RAs nucléaire),
- la protéine Ral, membre de la famille des Ras.
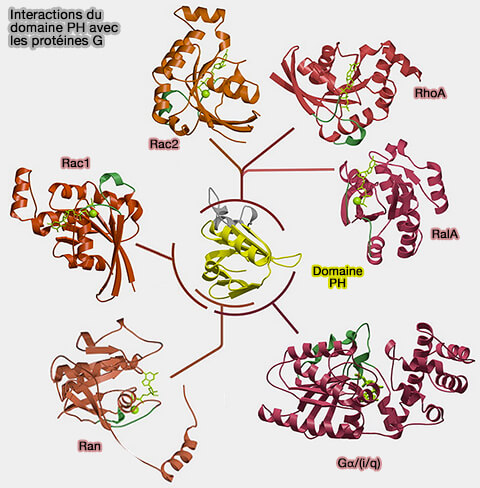
(Figure : vetopsy.fr d'après Sudol et coll)
3. La dynamine ainsi que certains membres de sa superfamille contient un domaine PH (
Les domaines PH forment l'anneau interne de la structure hélicoïdale liée à l'auto-assemblage (
(Figure : vetopsy.fr d'après Sudol et coll)
4. Le GRK2 (G protein Receptor Kinase-2 ou β adrenergic receptor kinase, βARK or BARK) est un des composants importants dans la désensibilisation de la signalisation liée aux protéines G et l'activation de voies de signalisation alternatives.
5. AKT/PKB est un membre de la famille des kinases AGC (famille des sérine/thréonine kinases) aux rôles importants dans le métabolisme cellulaire, la croissance cellulaire, la prolifération et la survie par la voie de signalisation AKT/PKB.
6. Des domaines PH interviennent aussi dans la transcription, le remodelage et la réparation de l'ADN comme TFIIH ou le complexe FACT.
7. Les domaines PH interviennent aussi en coopération avec d'autres domaines, que ce soient les domaines DH ou d'autres.
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


