Trafic vésiculaire
Endocytose clathrine-indépendante (CIE) à grande échelle
Phagocytose : initiation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires : trafic vésiculaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Lors de l'initiation de la phagocytose, après la détection (probing) de la proie, la membrane plasmique modifie sa composition lipidique et remodèle le cytosquelette d'actine avec l'aide des myosines.
Après la vue d'ensemble sur la phagocytose, étudions-en le mécanisme :
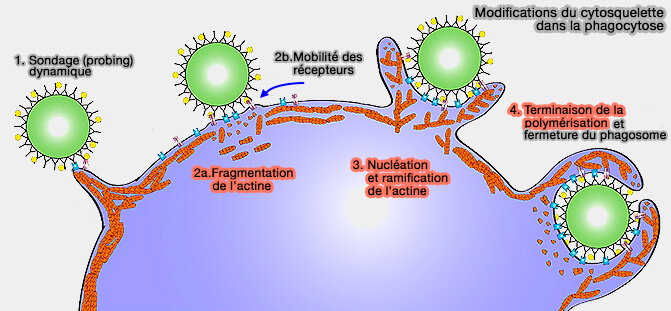
- 1. Détection de la particule par sondage (probing), i.e. voir aussi récepteurs phagocytaires
- 2. Initiation de la phagocytose : segmentation du réseau d'actine et mobilité des récepteurs phagocytaires
- 3. Formation de pseudopodes : nucléation et ramification de l'actine
- 4. Fermeture du phagosome
- 5. Maturation du phagosome

Nous décrirons les éléments essentiels de la phagocytose sans trop entrer dans les détails. La grande partie de ce chapitre est tirée de l'article : Phagocytosis: Our Current Understanding of a Universal Biological Process (2020) et Diffusion Barriers, Mechanical Forces, and the Biophysics of Phagocytosis (2016).
(Figure : vetopsy.fr d'après Thottacherry et coll)
2. Initiation de la phagocytose
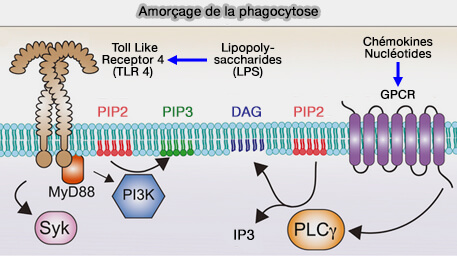
Modifications lipidiques
Au cours de la formation du phagosome, la membrane modifie sa composition lipidique.
1. Dans la phagocytose dépendante des récepteurs Fcγ, le phosphatidylinositol-4,5-bisphosphate PI(4,5)P2 s'accumule au départ au niveau de la cupule phagocytaire, pour diminuer rapidement ensuite (Localized Biphasic Changes in Phosphatidylinositol-4,5-Bisphosphate at Sites of Phagocytosis 2000).
a. Cette réduction de PI(4,5)P2 est essentielle pour l'internalisation des particules, probablement en facilitant le désassemblage du cortex cellulaire d'actine (Phosphatidylinositol-4,5-bis phosphate hydrolysis directs actin remodeling during phagocytosis 2005).
(Figure : vetopsy.fr d'après Ostrowski et coll)
b. Cette réduction de PI(4,5)P2 est sous le contrôle de PI3KC, une kinase PI3K, dont la phosphorylation produit PI(3,4,5)P3 au niveau de la cupule phagocytaire (Restricted Accumulation of Phosphatidylinositol 3-Kinase Products in a Plasmalemmal Subdomain during Fc Receptor-mediated Phagocytosis 2001).
c. En outre, PI(3,4,5)P3 recrute PLCγ (PhosphoLipase C gamma) qui produit du DAG (DiAcylGlycérol) et de l'IP3 (Inositol 1,4,5- triphosphate).
DAG, à son tour, induit l'activation de la PKCε pour une phagocytose améliorée (Differential Requirement for Classic and Novel PKC Isoforms in Respiratory Burst and Phagocytosis in RAW 264.7 Cells 2000).
(Figure : vetopsy.fr d'après Uribe-Querol et Rosales)
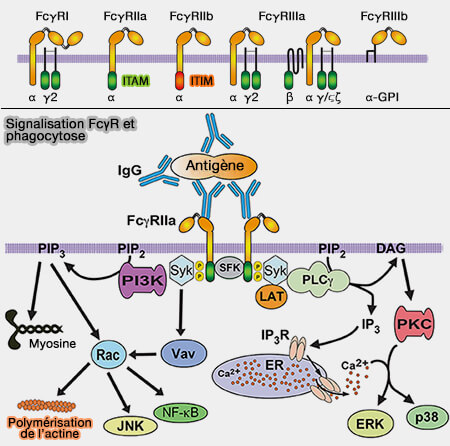
3. Si nous prenons par exemple la famille des récepteurs Fcγ, ceux-ci sont :
- soit dotés de motifs d'activation immunorécepteurs à base de tyrosine (ITAM),
- soit associés de manière non covalente à la chaîne γ commune contenant l'ITAM.
a. Lorsque la tyrosine est phosphorylée par une variété de kinases, comme la protéine kinase C, les kinases de la famille Src (SFK) et Syk (Spleen Tyrosine (Y) Kinase), les ITAM phosphorylés :
- permettent le regroupement des récepteurs Fcγ en microclusters par la fragmentation du cortex cellulaire,
- fournissent les sites d'amarrage pour les kinases qui propagent les cascades de signalisation conduisant au remodelage du cytosquelette.
b. Dans ce cas, les SFK ou les Syk sont les premiers éléments de la cascade de transduction du signal qui culmine avec la phagocytose.
Fragmentation du réseau d'actine
Les protubérances membranaires, i.e. les replis ou protrusions membranaires (ruffles) qui couvrent la particule cible, sont produites par le remodelage du réseau d'actine, qui s'effectue parallèlement aux changements de composition lipidique.
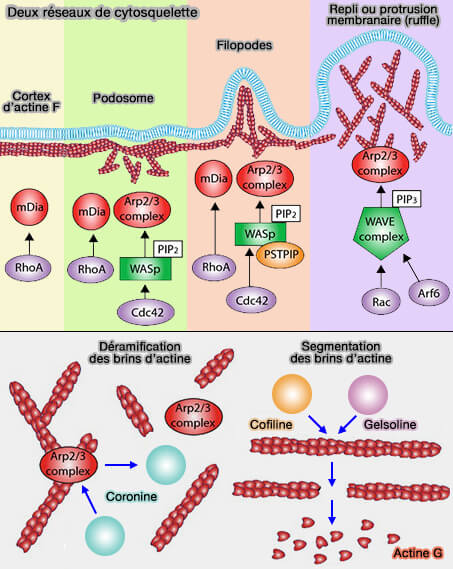
1. Le cytosquelette associé au cortex membranaire est modifié par l'action des protéines de fragmentation de l'actine-F :
-
" Sondage ou probing "des macrophages
(Figure : vetopsy.fr d'après Thottacherry et coll)
a. des filaments ramifiés par les coronines, qui interagissent avec Arp2/3, i.e. déramifient les branches de l'actine en laissant des fibres linéaires (Coronin-1 Function Is Required for Phagosome Formation 2005),
b. des filaments droits de l'actine-F qui vont la fractionner :
- par la cofiline (Roles of ADF/cofilin in actin polymerization and beyond 2010),
- par la gelsoline (Gelsolin: The Tail of a Molecular Gymnast 2013).

Ces trois protéines de fragmentation sont traitées dans des chapitres spéciaux.
2. Le détricotage Rho/formine/myosine-dépendante du cortex d'actine permet le regroupement (microcluster) des récepteurs (Essential and unique roles of PIP5K-γ and -α in Fcγ receptor-mediated phagocytosis 2009 et Actin Cytoskeleton Reorganization by Syk Regulates Fcγ Receptor Responsiveness by Increasing Its Lateral Mobility and Clustering 2014).
3. La phosphorylation de Syk recrute et active un certain nombre de régulateurs majeurs du squelette de l'actine (The SYK tyrosine kinase: a crucial player in diverse biological functions 2010) :
-
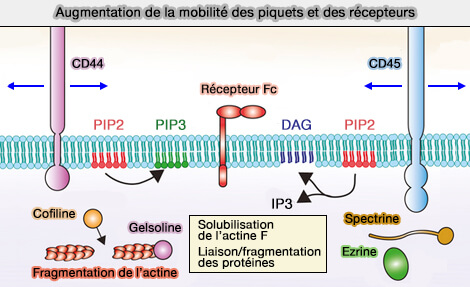
Augmentation de la mobilité par fragmentation de l'actine
(Figure : vetopsy.fr d'après Ostrowski et coll)
a. Vav est un GEF (Guanine nucleotide exchange factor) pour les petites GTPases de la famille Rho, via un module de domaines DH-PH en tandem (
b. La latrunculine (Lat), protéine d'attachement à la membrane, se lie à l'actine G et la séquestre, inhibant ainsi la polymérisation de l'actine-F.
De plus, lorsqu'elle est phosphorylée, elle sert de protéine d'échafaudage à SLP76, autre protéine d'échafaudage, fournissant ainsi une plate-forme pour le recrutement de nombreuses molécules de signalisation en aval, en particulier pour les récepteurs des cellules T.
3. L'hydrolyse locale de PI(4,5)P2 par PLCγ (PhosphoLipase C gamma), recrutée par Lat/SLP76 ou par les récepteurs couplés aux protéines G (GPCR), contribue à briser les barrières cytosquelettiques locales à la diffusion des récepteurs (Toll-like receptor ligands sensitize B-cell receptor signalling by reducing actin-dependent spatial confinement of the receptor 2015 et Functions of cofilin in cell locomotion and invasion 2013).
a. En effet, elle libère de la membrane plasmique :
- l'ezrine, protéine ERM d'attachement à la membrane,
- la cofiline déphosphorylée, donc sous sa forme active, mais désactivée par sa fixation à PI(4,5)P2.
b. La cofiline, déphosphorylée par la phosphatase SSH (SlingSHot) et libérée par la PLCγ, peut alors se lier à l'actine-F et initier la segmentation des filaments d'actine (Control of Actin Reorganization by Slingshot, a Family of Phosphatases that Dephosphorylate ADF/Cofilin 2002).
Rôles des myosines.
Une fois qu'une cible phagocytaire entre en contact avec la surface de la cellule, le regroupement des récepteurs et la signalisation en aval initient la formation de la cupule phagocytaire à base d'actine qui entoure la cible et implique probablement au moins deux classes de myosine (Squeezing in a meal: myosin functions in phagocytosis 2020 et Myosins: domain organisation, motor properties, physiological roles and cellular functions 2016).
Myosines I
Les myosines I sont des capteurs de déformations qui ont la particularité de se lier à l'actine comme les autres myosines par leur domaine moteur, mais aussi aux membranes.
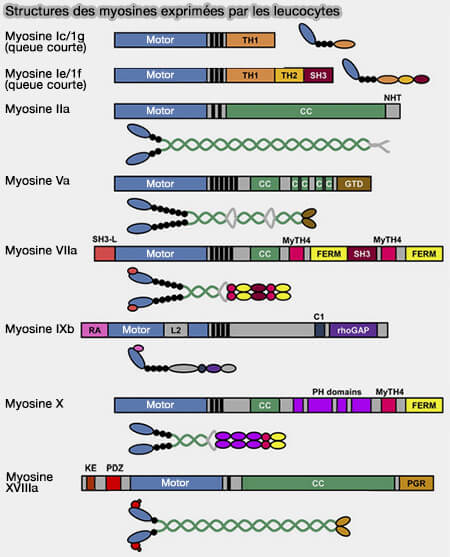
(Figure : vetopsy.fr d'après Maravillas-Montero et coll)
Le génome des mammifères code huit isoformes de myosine I (Myo1a-h) et les cellules immunitaires contiennent diverses combinaisons de myosine à queue courte comme Myo1c et Myo1g, et à longue queue comme Myo1e et Myo1f (The myosin family: unconventional roles of actin-dependent molecular motors in immune cells 2011).
1. Dans les macrophages, Myo1g, Myo1e et Myo1f sont recrutées dans la coupe phagocytaire lors de l'absorption de cibles recouvertes d'IgG.
- Myo1g est enrichi au niveau de la membrane le long des côtés de la cupule phagocytaire (The motor protein Myosin 1G functions in FcγR-mediated phagocytosis 2012).
- Myo1e et Myo1f se localisent au bord d'attaque de la cupule phagocytaire ainsi qu'à des sites d'adhésion distincts au sein de la cupule (Membrane-cytoskeletal crosstalk mediated by myosin-I regulates adhesion turnover during phagocytosis 2019).
2. La capacité des myosines I à se lier à la fois à l'actine et à la membrane et donc à maintenir l'adhésion membrane-cortex régule la tension membranaire, qui à son tour est importante pour la phagocytose.
- La réduction de l'adhésion membranaire-cytosquelettique au cours de la phagocytose, observée dans les macrophages doubles KO Myo1e et Myo1f, est en corrélation avec l'assemblage d'un réseau d'actine excessivement dense dans la cupule phagocytaire et une internalisation phagocytaire plus lente.
- Récemment, ces adhérences phagocytaires ont été comparées à des podosomes (Dynamic Podosome-Like Structures in Nascent Phagosomes Are Coordinated by Phosphoinositides 2019), des structures adhésives spécialisées à base d'actine capables de dégrader la matrice extracellulaire (ECM).
À l'avenir, il sera intéressant de déterminer s'il existe des parallèles mécanistiques entre le rôle des myosines dans la régulation de la dynamique des podosomes (Tail domains of myosin-1e regulate phosphatidylinositol signaling and F-actin polymerization at the ventral layer of podosomes 2018) et leur contribution à la dynamique de l'actine au sein de la cupule phagocytaire.
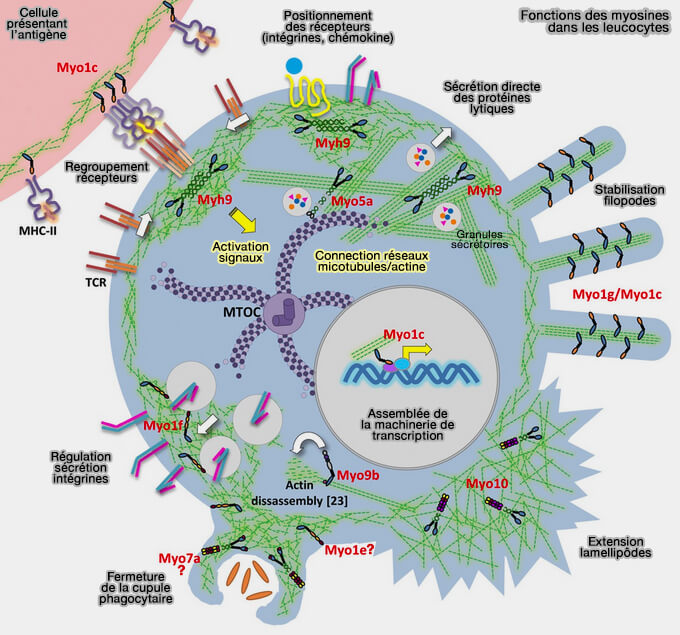
(Figure : vetopsy.fr d'après Maravillas-Montero et coll)
Myosines IX
La myosine IX est un moteur processif unique à tête unique, capable de rester attaché à un filament d'actine tout au long du cycle ATPase par une boucle étendue dans le domaine moteur (The Loop2 Insertion of Type IX Myosin Acts as an Electrostatic Actin Tether that Permits Processive Movement 2014).
1. La myosine IX, en particulier la IXb, apparaît, comme la myosine I, dans les cupules phagocytaires (Dynamics of Cytoskeletal Proteins during Fcγ Receptor-mediated Phagocytosis in Macrophages 2002).
Le KO de myosine IXb inhibe la phagocytose de billes chargées positivement et négativement de différentes tailles, ainsi que des globules rouges opsonisés par IgG (Identification of phagocytosis regulators using magnetic genome-wide CRISPR screens 2019).
2. La myosine IX est aussi un agent de réticulation de l'actine.
- La myosine IXa purifiée, mélangée à de l'actine, crée une structure de réseau d'actine régulièrement espacée (Self-organization of actin networks by a monomeric myosin 2016).
- La queue de la myosine IX contient un domaine RhoGAP, qui inactive spécifiquement la petite GTPase Rho. En conséquence, les macrophages myosine IXb KO présentent des niveaux significativement plus élevés de RhoA activé et ne peuvent pas former de saillies membranaires, conservant un aspect arrondi.
Son rôle devrait donc être essentiel pendant la dynamique de l'actine, mais l'assemblage de la cupule phagocytaire est plus complexe que nous ne le comprenons actuellement.
3. Formation des pseudopodes
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


