Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Lipolyse : ATGL
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'ATGL (Adipose TriGlycéride Lipase) est l'enzyme limitante de la lipolyse des gouttelettes lipidiques (LD) et transforme les triglycérides (TG) en diglycérides (DAG).
La lipolyse des LD fait intervenir d'autres lipases qui sont toutes étudiées dans des chapitres spécifiques :
- HSL (Hormone-Sensitive lipase), qui subit une translocation vers la LD, pour transformer les diglycérides (DAG) en monoglycérides (MG),
- MGL/MGAL (monoacylglycérol lipase), lipase cytosolique qui achève la dégradation en glycérol et acides gras (FA),
- LAL (Lipase lysosomale ou LIPA), enzyme qui catalyse les trois réactions précédentes dans les lysosomes lors de lipophagie.
Remarque : la lipolyse intervient aussi sur les lipoprotéines sanguines.
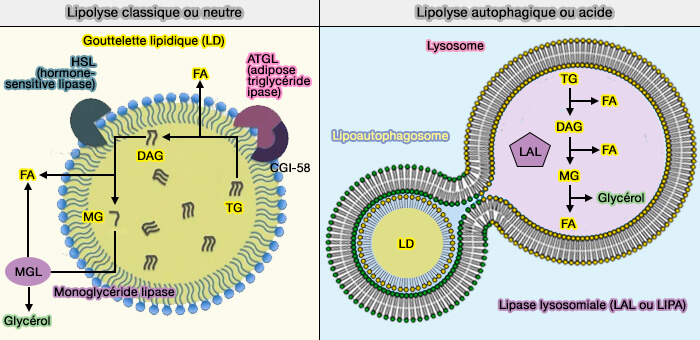
(Figure : vetopsy.fr)

Vous pouvez lire : Lipolysis: cellular mechanisms for lipid mobilization from fat stores (2021) qui décrit bien toutes les lipases et leur régulation.
Structure et fonctions d'ATGL (AdiposeTriGlycéride Lipase)
L'ATGL (Adipose TriGlycéride Lipase) appelée aussi PNPLA2 (PatatiN-like PhosphoLipAse domain-containing protein 2) est une enzyme clé initiant la lipolyse des gouttelettes lipidiques cytosoliques (cLD), dans les adipocytes du tissu adipeux et des tissus stéroïdogènes.
ATGL est l'enzyme limitante de la lipolyse cytosolique des gouttelettes lipidiques (LD).

Vous pouvez lire : Adipose Triglyceride Lipase Regulation: An Overview (2017) et Of mice and men: The physiological role of adipose triglyceride lipase (ATGL) (2019).
1. L'ATGL, i.e. EC 3.1.3.1, catalyse la première réaction lipolytique dans les LD, i.e. dégradation des triglycérides (TG) en diglycérides (DAG), en détachant de préférence l'acide gras (FA) en sn-2 du squelette du glycérol, pour générer des sn-1,3 diglycérides (DAG) et des acides gras ou FA (Studies on the Substrate and Stereo/Regioselectivity of Adipose Triglyceride Lipase, Hormone-sensitive Lipase, and Diacylglycerol-O-acyltransferases 2012).
$\ce{Triglycéride + H2O}$ $\leftrightharpoons$ $\ce{Diglycéride + acide gras + H+}$
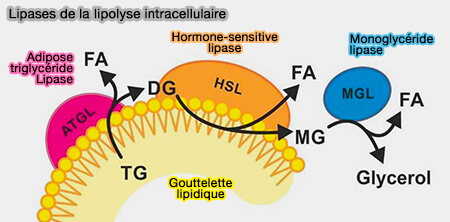
(Figure : vetopsy.fr d'après Cerk et coll)
La famille des protéines PNPLA comprend un total de neuf membres, PNPLA1 à PNPLA9, qui sont tous impliqués dans le métabolisme des lipides par le biais (Mammalian patatin domain containing proteins: a family with diverse lipolytic activities involved in multiple biological functions 2009 et Lipolysis: cellular mechanisms for lipid mobilization from fat stores 2021) :
- de leurs activités enzymatiques, phospholipase ou lipase,
- d'autres fonctions (
tableau).
2. L'ATGL humaine, composé de 504 acides aminés, est ubiquitaire, mais elle principalement exprimée dans le tissu adipeux. Sa structure n'est pas encore déchiffrée à l'heure actuelle.
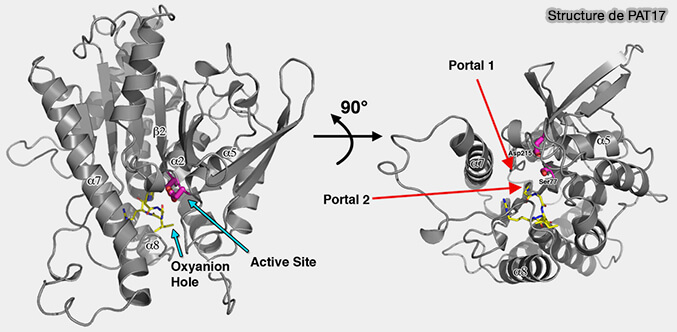
(Figure : vetopsy.fr d'après Wijeyesakere et coll)
a. Par homologie avec d'autres membres de sa famille comme PAT17, elle formerait un sandwich à trois couches, i.e. α-β-α (Crystal Structure of Patatin-17 in Complex with Aged and Non-Aged Organophosphorus Compounds 2014 ).
- Ser47 et Asp166, situés dans le domaine de type patatine, forment la dyade catalytique dans l'ATGL (Neutral lipid storage disease: genetic disorders caused by mutations in adipose triglyceride lipase/PNPLA2 or CGI-58/ABHD5 2009).
- Ser47 nucléophile réside dans un motif GXSXG généralement trouvé dans les hydrolases α-β.
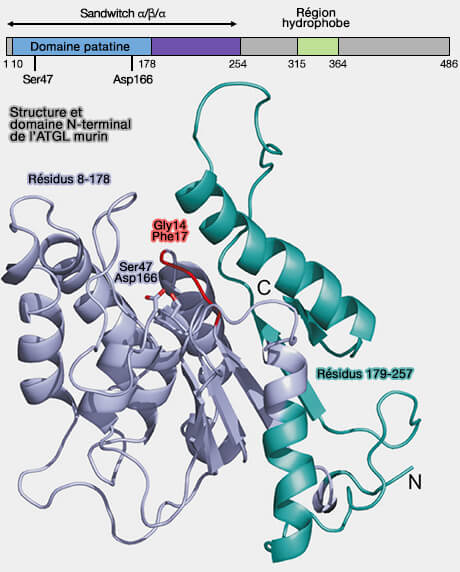
(Figure : vetopsy.fr d'après Cornaciu et coll)
b. La région N-terminale (résidus 1 à 254) de l'ATGL interagit directement avec sa protéine activatrice CGI-58/ABHD5 et sa protéine inhibitrice G0S2 (The Minimal Domain of Adipose Triglyceride Lipase (ATGL) Ranges until Leucine 254 and Can Be Activated and Inhibited by CGI-58 and G0S2, Respectively 2011).
Une hélice amphipathique N-terminale (Ile10-Gly24) est potentiellement impliquée dans la liaison des triglycérides (TG).
c. La région C-terminale intervient : (The C-terminal Region of Human Adipose Triglyceride Lipase Affects Enzyme Activity and Lipid Droplet Binding 2008) :
- dans son autorégulation, i.e. la suppression de 215 résidus, possède une activité lipolytique plus élevée, i.e. elle possède deux sites de phosphorylation Ser404 et Ser428 chez l'homme (
phosphorylation de l'ATG),
- dans sa localisation aux LD par une région hydrophobe (Pro315-Pro360).
3. L'ATGL est le plus souvent liée à la surface des LD. Toutefois, on trouve aussi de l'ATG cytosolique, libre ou le plus souvent lié à G0S2 à l'état basal, i.e. elle doit étre transportée alors vers les LD.
Le transport peut être assuré par des vésicules COPI, i.e. par un mécanisme classique ou par l'intervention d'une autre voie impliquant ELMOD2, une Arf-GAP non canonique.
Mécanisme
1. Dans des conditions basales, la surface de la LD contient, pour restreindre l'accès de l'ATGL aux réserves des triglycérides (TG) des LD :
- des périlipines (Plins), dont Plin1 lié au coactivateur de l'ATGL, i.e. CGI-58/ABHD5 (Comparative Gene Identification-58 ou A/B-hydrolase domain 5),
- CIDEC (Cell death–inducing DNA fragmentation factor-like effector C) de la famille des CIDE.
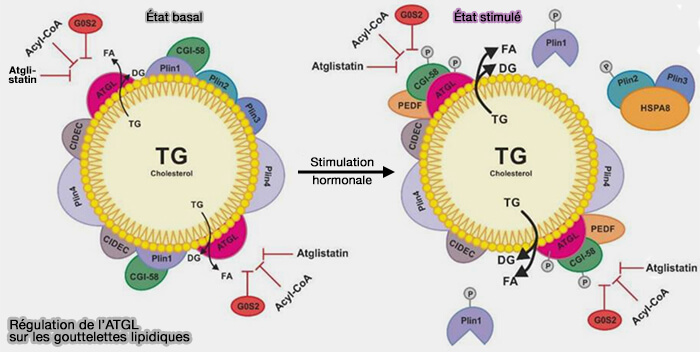
(Figure : vetopsy.fr d'après Cerk et coll)
2. Lors d'une stimulation hormonale, la phosphorylation de Plin1, Plin2, CGI-58/ABHD5 et ATGL entraîne un changement à la surface du LD.
a. L'ATGL humaine est phosphorylée sur Ser404 (406 chez la souris) et Ser428 (430 chez la souris).
-
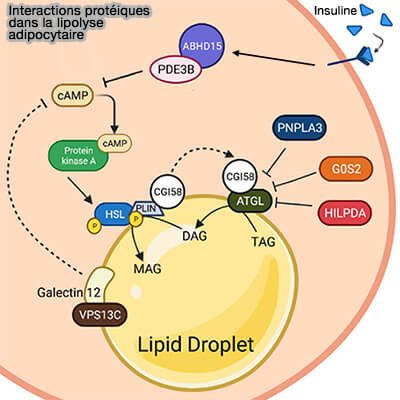
Interactions protéique dans la lipolyse adipocytaire
(Figure : vetopsy.fr d'après Li et coll) - De plus, la phosphorylation de Thr372, qui est située dans la région de liaison lipidique de l'ATGL, contribue potentiellement à la localisation de l'ATGL dans les LD (Identification of a novel phosphorylation site in adipose triglyceride lipase as a regulator of lipid droplet localization 2014).
b. La région N-terminale (résidus 1 à 254) de l'ATGL interagit directement avec CGI-58/ABHD5 (The Minimal Domain of Adipose Triglyceride Lipase (ATGL) Ranges until Leucine 254 and Can Be Activated and Inhibited by CGI-58 and G0S2, Respectively 2011).
c. La dissociation de CGI-58/ABHD5 phosphorylé de Plin1 phosphorylée permet son interaction avec ATGL, ce que active l'hydrolyse des TG.
d. Plin2 qui se trouve aussi sur les LD est phosphorylée elle aussi et est prise en charge, avec Plin3, par HSPA8/hsc70 pour leur dégradation (
Régulation
Outre les phosphorylations décrites ci-dessus, l'ATGL peut être régulée par d'autres mécanismes.
Protéines CIDE
L'interaction de l'ATGL avec la région C-terminale de CIDEC diminue la lipolyse en limitant l'accès de l'ATGL aux réserves de triglycérides (TG) des LD (

Les protéines CIDE sont étudiées dans un chapitre spécifique.
PEDF/SERPINF1
PEDF/SERPINF1 (Pigment epithelium derived factor/SERPIN family F member 1), composé de 418 résidus, interagit directement avec l'ATGL et stimule la lipolyse dans les adipocytes, les hépatocytes et la rétine (Pigment Epithelium–Derived Factor Regulates Lipid Metabolism via Adipose Triglyceride Lipase 2011 et PEDF and its roles in physiological and pathological conditions: implication in diabetic and hypoxia-induced angiogenic diseases 2015).
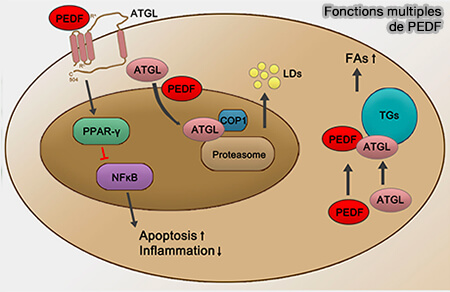
(Figure : vetopsy.fr d'après Xu et coll)
1. La séquence 44-mer comprenant Val78-Thr121 de PEDF est suffisante pour interagir directement avec l'ATGL et pour induire l'activité hydrolytique des triglycérides (TG) de l'ATGL (PEDF and PEDF-derived peptide 44mer stimulate cardiac triglyceride degradation via ATGL 2015).
Les résidus Thr210-Leu249 d'ATGL se lient sélectivement à cette séquence et même à un fragment de 17-mer plus court (Gln98-Ser114) de PEDF (Small Retinoprotective Peptides Reveal a Receptor-binding Region on Pigment Epithelium-derived Factor 2015).
2. PEDF est une protéine multifonctionnelle dotée de propriétés neurotrophiques et les résidus Val58-Thr101 sont potentiellement impliqués dans la liaison aux récepteurs PEDF (Receptors that bind to PEDF and their therapeutic roles in retinal diseases 2023).
G0S2 (G0/G1 switch gene 2)
G0S2 (G0/G1 switch gene 2) composé de 106 résidus à tout d'abord été décrit comme un régulateur du cycle cellulaire médiateur de la réentrée G0/G1.
1. Ses taux sont variables au cours du cycle alimentaire (Targeted Disruption of G0/G1 Switch Gene 2 Enhances Adipose Lipolysis, Alters Hepatic Energy Balance, and Alleviates High-Fat Diet–Induced Liver Steatosis 2014).
- G0S2 inhibe l'activité de l'ATGL et diminue la lipolyse en se liant à ATGL, i.e. le domaine hydrophobe central de G0S2 interagit avec le domaine PAT de l'ATGL (The G0/G1 Switch Gene 2 Regulates Adipose Lipolysis through Association with Adipose Triglyceride Lipase 2010).
- Ce site diffère de celui de CGI-58/ABHD5 et ils n'entrent pas en compétition.
- En outre, G0S2 possède également une activité lysophosphatidyl-acyltransférase comme AGPAT2 et joue un rôle essentiel dans la promotion de la synthèse hépatique des triglycérides (Identification of an intrinsic lysophosphatidic acid acyltransferase activity in the lipolytic inhibitor G0/G1 switch gene 2 (G0S2) 2019).
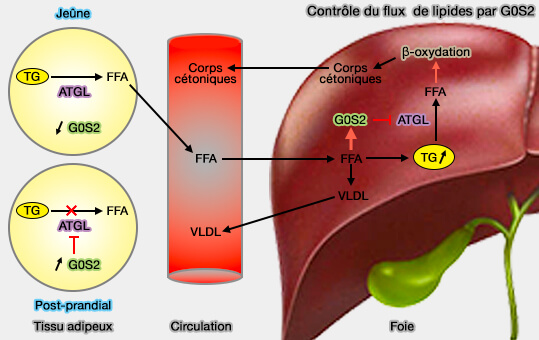
(Figure : vetopsy.fr d'après Zhang et coll)
Cette double fonction, agissant à la fois comme enzyme de synthèse des lipides et comme inhibiteur de l'ATGL, permet à G0S2 de jouer le rôle important de régulateur du stockage des lipides et de l'équilibre de la mobilisation pour contrôler les niveaux intracellulaires d'acides gras (G0S2: a small giant controller of lipolysis and adipose-liver fatty acid flux 2017).
HILPDA/HIG2
HILPDA/HIG2 (Hypoxia-Induced Lipid Droplet-Associated protein ou Hypoxia-Induced Gene-2), composé de 63 résidus, inhibe l'activité de l'ATGL comme G0S2, par interaction physique directe, même si son pouvoir inhibiteur est inférieur à celui de G0S2 (Hypoxia-inducible lipid droplet-associated protein inhibits adipose triglyceride lipase 2018).
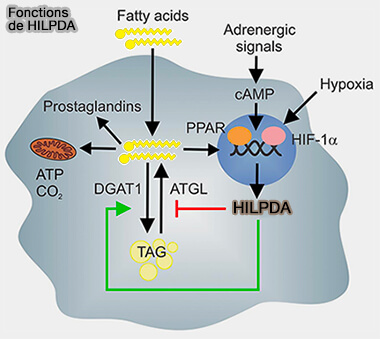
(Figure : vetopsy.fr d'après de la Rosa Rodriguez et coll)
1. Le promoteur du gène Hilpda héberge un certain nombre d'éléments sensibles à l'hypoxie qui sont ciblés par les facteurs de transcription HIF-1 et HIF-2 (Hypoxia-inducible protein 2 is a novel lipid droplet protein and a specific target gene of hypoxia-inducible factor-1 2010)
Cette inhibition se fait en présence ou en absence de CGI-58/ABHD5, i.e. ils n'entrent pas en compétition (Regulation of lipid droplet homeostasis by hypoxia inducible lipid droplet associated HILPDA 2020)
2. Indépendamment de son action sur l'ATGL, il stimule également la synthèse des triglycérides médiée par DGAT1, donc réduit par une autre voie les acides gras (FA) libres (Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes 2021)
Autres régulateurs
1. PNPLA3 pourrait se lier avec CGI-58/ABHD5 pour inhiber la lipolyse par ATGL qui rappelons-le s'appelle aussi PNPLA2.
2. LC-Coa (Long-Chain fatty acyl–CoA) agirait comme un inhibiteur non compétitif d'ATGL, où il se lie à CGI-58/ABHD5 et interagit avec Plin1.
Le complexe LC-CoA/CGI-58/Plin1 entraîne la désactivation de l'ATGL.
Retour vers la lipolyse adipocytaire
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


