Bioénergétique
AMPK (AMP-activated protein kinase) : activation et fonctions
Interface entre signalisation et bioénergétique
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L’activation de l'AMPK (AMP-activated protein kinase) dépend de la charge énergétique cellulaire, sert de commutateur entre catabolisme et anabolisme.
(Figure : vetopsy.fr d'après Garcia et Shaw)
Activation de l'AMPK
La sous-unité γ détecte les changements dans le rapport AMP/ATP, (
- Lors d'un excès d’énergie, l'ATP se lie aux sites et l'AMPK reste inactive.
- Lors d'une baisse d'énergie, i.e. hausse de l’AMP par rapport à l’ATP, l'AMP remplace l’ATP sur les sites et active l'AMPK.

L'AMPK est le capteur maître de l'énergie cellulaire et le régulateur de l'homéostasie énergétique chez les eucaryotes.
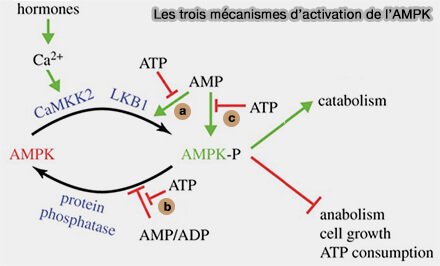
L'AMP active l'AMPK par trois mécanismes (Keeping the home fires burning : AMP-activated protein kinase 2018) :
- phosphorylation de l'AMPK,
- changement conformationnel,
- inhibition de la déphosphorylation.
Phosphorylation de l'AMPK
(Figure : vetopsy.fr d'après Hardi)
Les protéines kinases phosphorylent et activent souvent d’autres protéines kinases, formant des chaînes de protéines kinases, appelées cascades de protéines kinases (AMP Is a True Physiological Regulator of AMP-Activated Protein Kinase by Both Allosteric Activation and Enhancing Net Phosphorylation 2013).
1. L’AMPK ne fait pas exception à cette règle et est activée, en amont, par phosphorylation de la thréonine-172.
- LKB1 (tumour suppressor kinase liver kinase B1) semble être constamment actif, mais constitue un élément clé du mécanisme par lequel AMPK est capable de détecter l’état énergétique de la cellule (The Tumor Suppressor Kinase LKB1: Metabolic Nexus 2022).
- CaMKKβ est activée par l’augmentation des concentrations intracellulaires d’ions Ca++ liés à la calmoduline, ce qui se produit en réponse à de nombreuses hormones agissant sur les cellules, plaquettes, neurones… (Characterization of the CaMKK β-AMPK Signaling Complex 2011).
2. Cette phosphorylation accroit de plus de 100 fois l'activité de la kinase.
Changement conformationnel et inhibition de la déphosphorylation
La liaison de l'AMP provoque :
- un changement conformationnel,
- l'inhibition de la déphosphorylation de Thr172 par les phosphatases protéiques, qui est liée à l'activation allostérique.

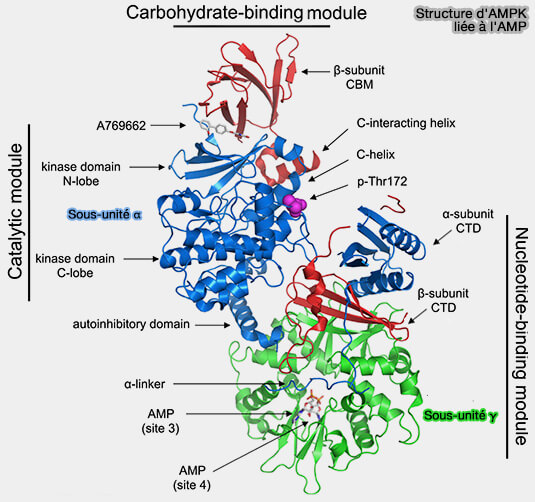
Le site critique pour les deux derniers mécanismes est le CBS3.
Remarque : le site 3 se lie aussi au NADPH.
(Figure : vetopsy.fr d'après Hardi)
1. Le lien α, i.e. α-linker, qui relie l'AID à l'α-CTD, contient deux motifs de séquence conservés, i.e. RIM1 et RIM2 (regulatory subunit interaction motif).
- RIM1 interagit avec la surface de CBS2 à proximité du site inoccupé.
- RIM2 interagit avec la surface de CBS3 par des résidus qui interagissent également avec l'AMP lié dans le site 3.
2. L'α‐AID et l'α‐linker semblent former une charnière flexible entre deux régions de l'hétérotrimère :
- le module catalytique contenant le α‐KD and β‐CBM,
- le module de liaison nucléotidique contenant la sous-unité α‐CTD, β‐CTD et γ.
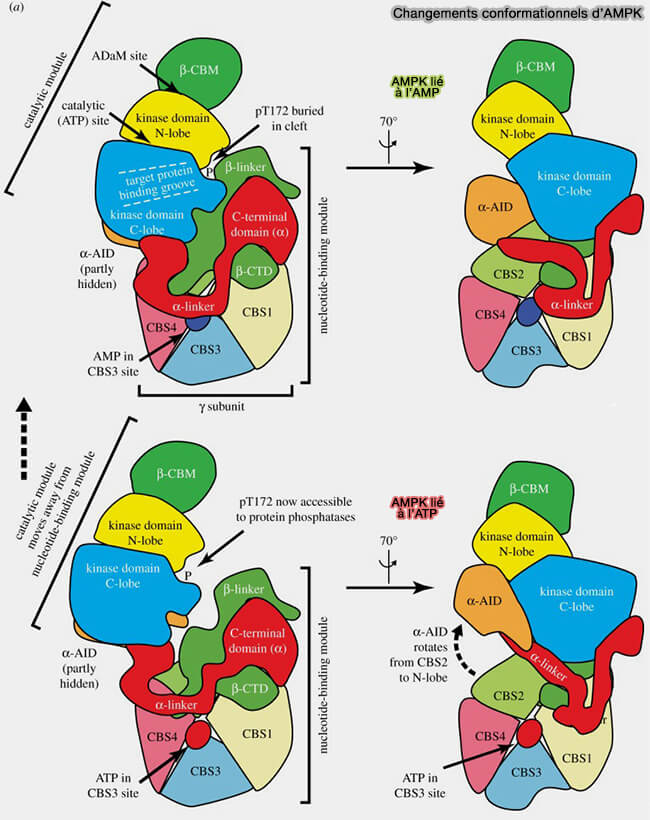
a. La liaison de l'AMP au site 3 favorise l'interaction entre la séquence RIM2 et CBS3, forçant l'α‐linker à éloigner l'AID de son interaction inhibitrice derrière l'α‐KD, i.e. provoquant l'activation allostérique par l'AMP.
b. Inversement, lorsque l'ATP est lié au site 3, l'α‐linker se dissocie de la sous-unité γ, ce qui permet à l'AID de revenir dans sa position inhibitrice derrière l'α‐KD (Structure of an AMPK complex in an inactive, ATP-bound state 2à21).
La séparation partielle des modules de liaison catalytique et nucléotidique, autorisée par cette libération de l'α‐linker, expose le groupe phosphate sur Thr172, qui, dans la structure liée à l’AMP, est enterré dans une fente étroite entre les deux modules, et le rend accessible à la déphosphorylation par les protéines phosphatases.
3. Si CBS3 est le site critique où l’activateur AMP entre en compétition avec l’inhibiteur ATP, quel est le rôle de CBS1 et CBS4 (Deconvoluting AMP-activated protein kinase (AMPK) adenine nucleotide binding and sensing 2017) ?
a. Les groupes phosphate des trois nucléotides liés se rapprochent dans le tunnel aqueux au centre de la sous-unité γ, de telle sorte que les trois sites entrent en interaction.
b. La présence de nucléotides d’adénine dans les deux autres sites modifie la forme du site CBS3 de sorte qu’il se lie à l’AMP avec une affinité presque 10 fois supérieure à celle de l’ATP.
- CBS1 se lie à l'AMP avec une affinité plus faible que CBS3.
- CBS4 est nécessaire à la détection de l’AMP, en stabilisant la liaison de l’AMP au niveau de CBS3 sur His298, ce qui augmente à la fois l’affinité pour l’AMP et la liaison préférentielle de l’AMP sur l’ATP.
c. Cela explique comment la sous-unité γ est capable de détecter de petits changements dans l’AMP même en présence de concentrations 100 fois plus élevées d’ATP, ce qui pourrait potentiellement être considéré comme une tâche difficile compte tenu des similitudes chimiques des deux nucléotides.
Remarque : et l'ADP dans le mécanisme ?
L'ADP ne serait capable que d'inhiber la déphosphorylation de l'AMPK, mais pas sa phosphorylation, ni son changement conformationnel (AMP Is a True Physiological Regulator of AMP-Activated Protein Kinase by Both Allosteric Activation and Enhancing Net Phosphorylation 2013).
Fonction principale de l’AMPK
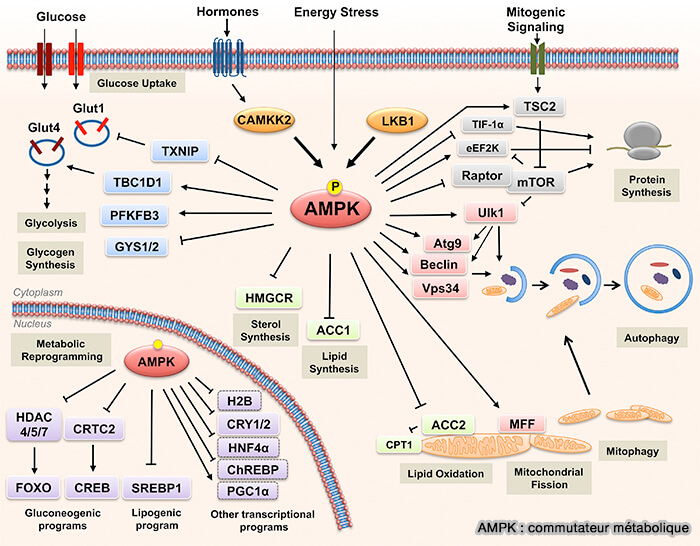
1. L'AMPK agit comme un commutateur métabolique qui oriente le métabolisme vers la production d’ATP en période de stress énergétique par :
- le maintien de l’équilibre énergétique cellulaire,
- la régulation de la glycémie et du poids corporel,
- la protection contre le stress métabolique, i.e. jeûne, exercice, hypoxie…

Vous pouvez lire : AMPK: Mechanisms of Cellular Energy Sensing and Restoration of Metabolic Balance (2017).
(Figure : vetopsy.fr d'après Garcia et coll)
| Effets d’AMPK | |||
|---|---|---|---|
| Activation des voies cataboliques (productrices d’ATP) |
Inhibition des voies anaboliques (consommatrices d’ATP) |
||
| Glycolyse | Activation indirecte (phospho- fructokinase 2) |
Synthèse des acides gras |
Inhibition de l’ACC (➘ malonyl-CoA) |
| β-oxydation |
Activation via inhibition de l’ACC (acétyl-CoA carboxylase) |
Synthèse des protéines |
Inhibition de mTORC1 |
| Prise de glucose |
Augmentation de GLUT4 dans le muscle |
Synthèse du glycogène |
Inhibition indirecte (via inactivation de la glycogène synthase) |
| Autophagie | Stimulation en cas de stress prolongé |
Gluconéogenèse hépatique |
Inhibition de facteurs de transcription comme PGC-1α |
2. L'AMPK constitue une cible thérapeutique majeure, par le site ADaM, pour :
- les maladies métaboliques, i.e. diabète de type 2, obésité (AMPK signaling in diabetes mellitus, insulin resistance and diabetic complications: A pre-clinical and clinical investigation 2022),
- les maladies cardiovasculaires (AMPK: Potential Therapeutic Target for Ischemic Stroke 2018),
- les maladies neurodégénératives (AMPK Signaling Pathway as a Potential Therapeutic Target for Parkinson’s Disease 2023).
Synthèse de l'ATP
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


