Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Lipolyse et fusion des LD : protéines CIDE
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les protéines CIDE (Cell death-Inducing DNA Fragmentation Factor Alpha (DFFA)-like Effector) sont des protéines associées aux gouttelettes lipidiques (LD) qui régulent le métabolisme des lipides et la fusion des LD.
À l’origine, sur la base de leur homologie avec les facteurs de fragmentation de l’ADN, ces protéines avaient été identifiées comme protéines apoptotiques.
Vue d'ensemble des CIDE

Vous pouvez lire : CIDE family proteins control lipid homeostasis and the development of metabolic diseases (2020) et CIDE Proteins in Human Health and Disease (2019).
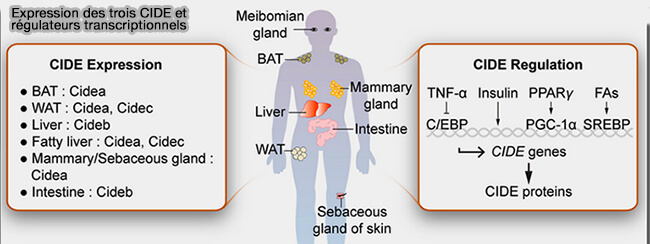
1. Les protéines CIDE (Cell death-Inducing DNA Fragmentation Factor Alpha (DFFA)-like Effector) comprennent trois membres.
a. CIDEA et CIDEC, appelé aussi FSP27 (Fat-Specific Protein 27), sont essentiellement exprimés dans les adipocytes, i.e. :
- CIDEA dans l'appareil de Golgi des adipocytes blancs et bruns,
- CIDEC sur le réticulum endoplasmique (RE) des adipocytes blancs.
b. CIDEB est exprimé dans les hépatocytes.
(Figure : vetopsy.fr d'après Chen et coll)
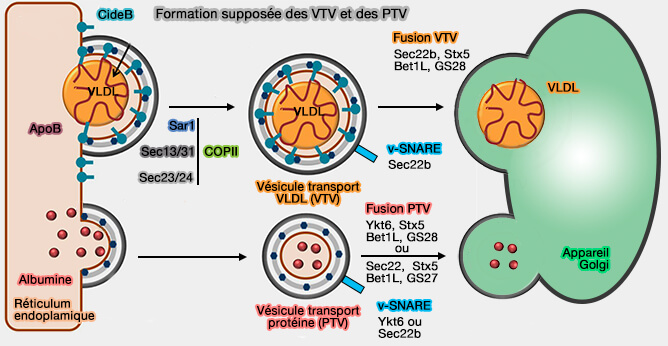
2. CIDEB se retrouve dans les vésicules transportant les VLDL (lipoprotéines de très basse densité), appelées VTV depuis le RE et régule leur biogenèse ainis que celle des chylomicrons (CM).

CIDEB est étudié dans un chapitre spécial et ici nous nous intéressons à CIDEC.
(Figure : vetopsy.fr d'après Tiwari et coll et Siddiqi et coll).
Fonctions de CICEC
CIDEC/FSP27 :
- inhibe la lipolyse par des mécanismes pas bien élucidés, i.e. les modèles ne formulent que des hypothèses.
- joue un rôle dans la fusion et la croissance des gouttelettes lipidiques (LD).
1. CIDEC/FSP27 (Cell death activator CIDE-3/Fat-Specific Protein 27), composé de 238 résidus dans la forme canonique, i.e. 3 formes d'épissage chez l'homme, est fortement exprimée dans les adipocytes et associé aux LD (The Lipolysome-A Highly Complex and Dynamic Protein Network Orchestrating Cytoplasmic Triacylglycerol Degradation 2020).
- L'absence de FSP-27 chez la souris et l'homme provoque une lipodystrophie accompagnée de l'apparition d'adipocytes blancs multiloculaires atypiques et de taux de lipolyse plus élevés.
- À l’inverse, la surexpression de FSP-27 est associée à la formation de LD surdimensionnées et à une accumulation de lipides neutres dans divers types de cellules.
Les protéines CIDE sont aussi enrichies au niveau des sites de contact membranaire (MCS), en particulier LD/RE et LD/LD, attachant physiquement les organites adjacents en formant des dimères (FSP27 Promotes Lipid Droplet Clustering and Then Fusion to Regulate Triglyceride Accumulation 2011).
(Figure : vetopsy.fr d'après Chen et coll)
Chez la souris, CIDEB favorise le stockage des lipides dans le foie des souris soumises à un régime alimentaire régulier, mais CIDEA et FSP27 augmentent la taille des gouttelettes dans des conditions riches en lipides (Differential Roles of Cell Death-inducing DNA Fragmentation Factor-α-like Effector (CIDE) Proteins in Promoting Lipid Droplet Fusion and Growth in Subpopulations of Hepatocytes 2016).
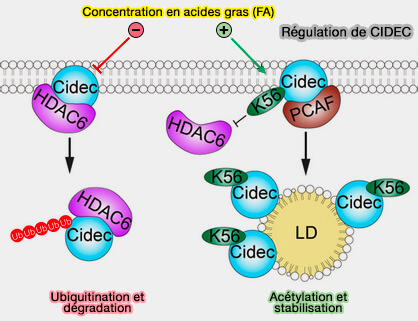
2. Les fonctions de CIDEC sont contrôlées par l'acétylation de K56.
- Lorsque la concentration des FA en faible, CIDEC ne doit pas être actif, i.e. CIDEC interagit avec HDAC6 (Histone Désacétylase 6) qui inhibe son acétylation, et CIDEC est rapidement dégradé par son ubiquination (Rôle de l'histone désacétylase HDAC6 au cours de l'érythropoïèse humaine 2022).
- Lorsque la concentration des FA en faible, CIDEC doit étre actif pour interagir avec ses partenaires, i.e. HDAC6 se dissocie du CIDEC qui s'associe avec PCAF (P300/CBP-associated factor) pour son acétylation sur K56, ce qui améliore sa stabilité (HDAC6-mediated acetylation of lipid droplet–binding protein CIDEC regulates fat-induced lipid storage 2017).
inhibition de la lipolyse
Interactions de CIDEC
CIDEC interagit avec plusieurs partenaires.
1. L'interaction de l'ATGL (Adipose TriGlycéride Lipase) avec la région C-terminale de CIDEC hébergeant les résidus Ser120-Pro220 diminue la lipolyse en limitant l'accès de l'ATGL aux réserves TG des LD (Distinct Mechanisms Regulate ATGL-Mediated Adipocyte Lipolysis by Lipid Droplet Coat Proteins 2013)
Cette région C-terminale de CIDEC est également responsable de l'interaction avec Plin1 favorisant sa co-localisation et l'agrandissement de la taille du LD (
Un modèle hypothétique a été suggéré (Fat-specific Protein 27 (FSP27) Interacts with Adipose Triglyceride Lipase (ATGL) to Regulate Lipolysis and Insulin Sensitivity in Human Adipocytes 2014).
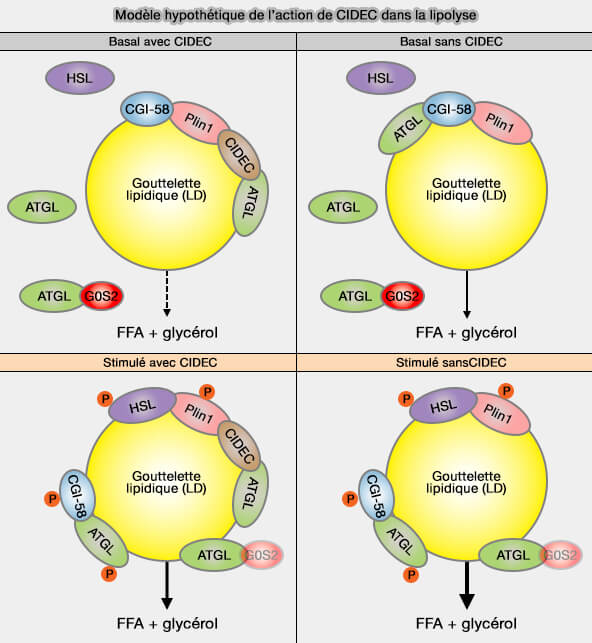
(Figure : vetopsy.fr d'après Grahn et coll)
a. À l'état basal, la péripiline1 (Plin1) sert d'échafaudage pour un complexe formé par CGI-58/ABHD5, le co-activateur de ATGL qu'elle sequestre, et FSP27 en interaction avec ATGL, et peut être d'autres périlipines, i.e. la lipolyse est diminuée.
- ATG libre serait inhibé par l'interaction avec G0S2.
- En absence de CIDEC, ATGL pourrait interagir avec CGI-58, entraînant une lipolyse accrue.
b. Lors de stimulation β-adrénergique en présence de CIDEC, l'activation de la PKA entraîne la phosphorylation de PLIN1 et de HSL, provoquant la libération de CGI-58/ABHD5, qui se lie à et stimule l'ATGL.
- L'ATGL non lié subit une translocation vers les LD et G0S2 est régulé négativement pour augmenter la lipolyse médiée par l'ATGL.
- En l'absence de CIDEC, l'ATGL autrement séquestré est maintenant disponible pour la liaison au CCGI-58/ABHD5, ce qui entraîne des niveaux de lipolyse encore plus élevés.
3. De plus, CIDEC interagit directement avec la protéine répresseur Erg1, conduisant à la liaison d'Erg1 à la région promotrice ATGL/PNPLA2, ce qui supprime sa transcription (Fat-specific Protein 27 Inhibits Lipolysis by Facilitating the Inhibitory Effect of Transcription Factor Egr1 on Transcription of Adipose Triglyceride Lipase 2014 ).
Mécanismes de CIDEC
CIDEC/FSP27 inhibe la lipolyse par des mécanismes qui ne sont pas encore bien compris à l'heure actuelle et qui seraient au nombre de 3.
1. CIDEC interagit avec l'ATGL et inhibe la libération de glycérol médiée par l'ATGL.
Cependant, contrairement à G0S2 et HILPDA, FSP-27 n’inhibe pas l’activité TAG hydrolase in vitro , ce qui suggère que FSP-27 limite l’accès d’ATGL aux LD ou interfère avec son interaction avec ABHD5 (Distinct Mechanisms Regulate ATGL-Mediated Adipocyte Lipolysis by Lipid Droplet Coat Proteins 2011).
2. CIDEC est enrichi au niveau des sites de contact LD/LD dans les adipocytes (
3. L’impact inhibiteur du CIDEC sur la lipolyse pourrait expliquer paradoxalement la fonction pro-lipolytique de l’hormone de croissance (GH) par plusieurs processus (The effects of growth hormone on adipose tissue: old observations, new mechanisms 2020).
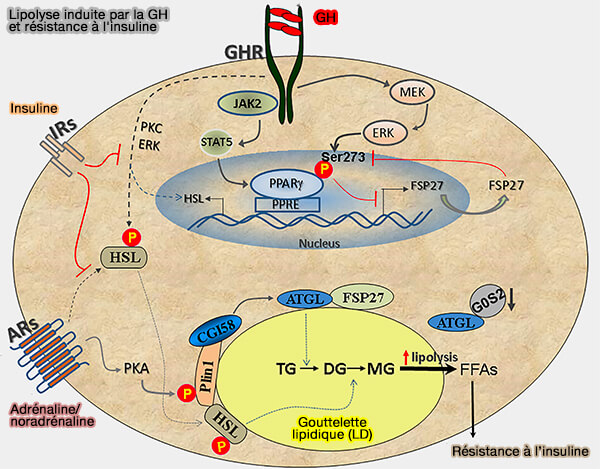
(Figure : vetopsy.fr d'après Kopchick et coll)
a. La signalisation induite par la GH active la voie MEK/ERK, qui provoque la phosphorylation de PPARγ au niveau de Ser273, entraînant son inactivation et la régulation négative de CIDEC (Growth hormone acts along the PPARγ-FSP27 axis to stimulate lipolysis in human adipocytes 2019).
La diminution de l’expression de CIDEC entraîne une augmentation de la lipolyse et une augmentation des acides gras libres (FFA) circulatoires, caractéristiques de la résistance à l’insuline et du diabète sucré de type 2.
b. En outre, la GH active HSL en augmentant l'expression de novo de l'ARNm de HSL via l'activation de PKC et ERK.
Remarque : l'atglistatine qui inhibe aussi l'ATGL n'est présente que chez la souris (Pharmacological inhibition of adipose tissue adipose triglyceride lipase by Atglistatin prevents catecholamine-induced myocardial damage 2022).
Expansion et fusion des LD
Interactions des dimères avec la LD
L'expansion et la fusion des gouttelettes lipidiques facilite le stockage efficace des triglycérides (TG) réduisant ainsi la surface de la gouttelette lipidique exposée aux lipases cytosoliques pour la lipolyse. CIDEC est enrichi au niveau des sites de contact membranaires (MCS) des LD dans les adipocytes.
1. Les CIDE présentent une hélice amphipathique C-terminale qui se lie à l’acide phosphatidique (PA) de la membrane de la LD (The brown adipocyte protein CIDEA promotes lipid droplet fusion via a phosphatidic acid-binding amphipathic helix 2015).
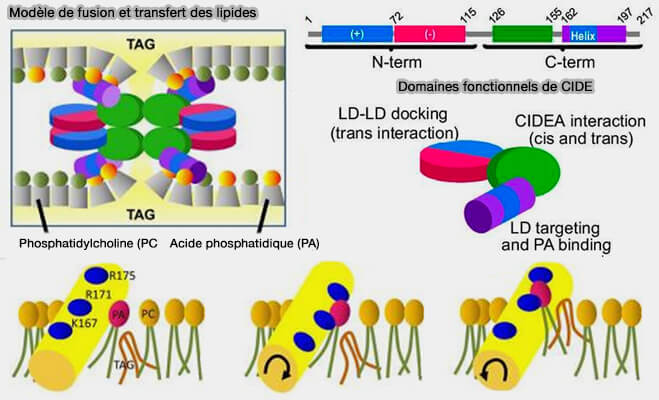
(Figure : vetopsy.fr d'après Barneda et coll)
a. Or, l'acide phosphatidique (PA), en forme de cône, facilite la fusion dans les MCS LD/LD.
Cet ancrage précède la fusion des gouttelettes lipidiques (Fsp27 promotes lipid droplet growth by lipid exchange and transfer at lipid droplet contact sites 2011).
b. En outre, l'ammarrage de l'hélice amphipatique peut créer une perturbation locale de la barrière phospholipidique qui augmentera sa perméabilité aux TG.
Elle pourrait faciliter l’intégration des TG au sein des queues hydrophobes phospholipidiques en réduisant l'énergie nécessaire au transfert, aidé en cela par les CIDE.
2. Les oligomères CIDE, en plus d'attacher les deux LD, formeraient des pores ou des canaux pour le passage des TG entre les LD, invariablement de la plus petite à la plus grosse grâce aux différences de pression interne et de tension superficielle.
a. L'interaction homodimérique CIDE-N/CIDE-N, nécessaire à l'homodimérisation, est médiée par attraction électrostatique et son abolition conduit à l'arrêt des activités de fusion et de croissance des LD.
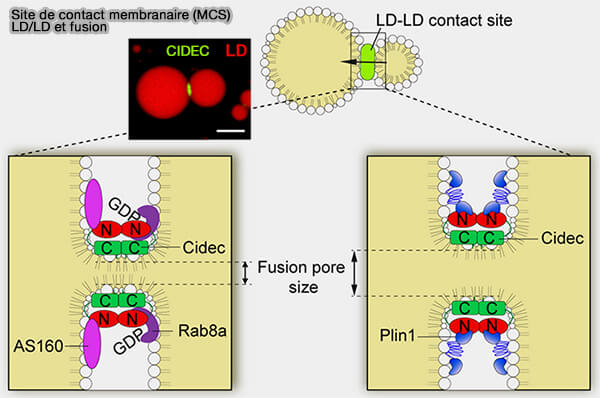
(Figure : vetopsy.fr d'après Chen et coll)
b. Les domaines C-terminaux du CIDEC interagissent les uns avec les autres pour cibler et enrichir les LD.
Les résidus 136-217 sont requis pour l'enrichissement du CIDEC (Negatively-charged residues in the polar carboxy-terminal region in FSP27 are indispensable for expanding lipid droplets 2016).
c. Certains des résidus basiques lysine et arginine conservés (KRR dans CIDEA et CIDEB ou RKKR dans CIDEC) dans la région amphipathique α-hélicoïdale sont indispensables pour la fusion des LD et la croissance des LD en médiant l'interaction CIDEC-phospholipide (Polybasic RKKR motif in the linker region of lipid droplet (LD)–associated protein CIDEC inhibits LD fusion activity by interacting with acidic phospholipids 2018).
Interactions de CIDEC
1. La fusion de gouttelettes lipidiques médiée par CIDEC est régulée par les interactions avec PLIN1(FSP27 and PLIN1 interaction promotes the formation of large lipid droplets in human adipocytes 2014).
- La région N-terminale de CIDEC, par 6 lysines (K53, K75, K77, K112, K115 et K117) interagirait avec le motif riche en résidus acides, i.e. résidus 292-319 de Plin1 (Perilipin1 promotes unilocular lipid droplet formation through the activation of Fsp27 in adipocytes 2013)
- Plin1 favoriserait la fusion et la croissance des LD médiées par CIDEC, peut-être en élargissant la taille des pores ou en augmentant la tension superficielle des LD ou éventuellement en influençant l'oligomérisation de CIDEC.
(Figure : vetopsy.fr d'après Bersucker et coll)
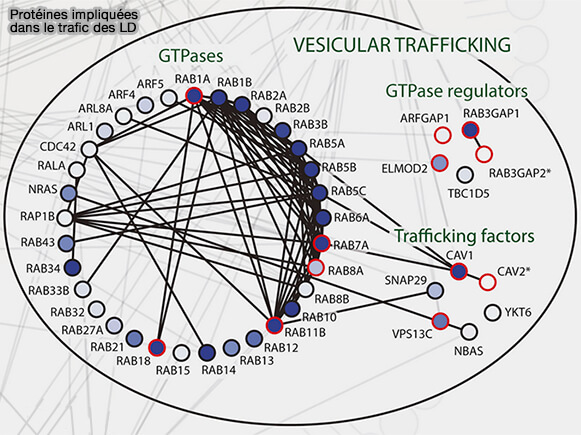
2. Les Rab GTPases sont des régulateurs répandus de la dynamique membranaire et de nombreux Rab se localisent dans des gouttelettes lipidiques (A Proximity Labeling Strategy Provides Insights into the Composition and Dynamics of Lipid Droplet Proteomes 2018).
Rab8a intervient en particulier dans les endosomes de recyclage ou dans le trafic vésiculaire, i.e. endocytoses indépendantes de la clathrine (CIE).
Il se concentre aussi au niveau des MCS LD/LD pour la fusion et son activité est régulé par (Rab8a-AS160-MSS4 Regulatory Circuit Controls Lipid Droplet Fusion and Growth 2014) :
- AS160/BC1D4 (Akt substrate of 160 kD), la GAP qui transforme le Rab8a-GTP en Rab8a-GDP,
- MSS4 ((mammalian suppressor of Sec4) fonctionne comme une GEF négativement par le GEF.
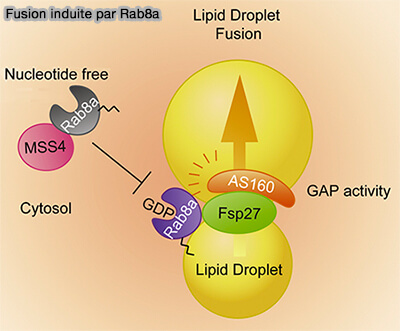
(Figure : vetopsy.fr d'après Wu et coll)
a. Rab8a-GDP, contrairement aux autres Rab qui sont sous forme GTP, est recruté dans les MCS LD/LD grâce à son interaction directe avec le domaine C-terminal du CIDEC.
AS160 interagit avec le domaine N-terminal de CIDEC pour former un complexe avec Rab8a au niveau des PMA.
b. À l'inverse, MSS4 favorise la dissociation de Rab8a des MCS via l'hydrolyse du GTP de Rab8a et inhibe ainsi la fusion LD médiée par CIDEC.
c. Le mécanisme moléculaire par lequel Rab8a régule la formation de LDCS médiée par CIDEC reste insaisissable et il semblerait que d’autres Rab GTPases puissent intervenir pour enrichir en CIDEC las MCS.
Modèle de fusion
Ce modèle en 5 étapes est tiré de : CIDE family proteins control lipid homeostasis and the development of metabolic diseases (2020).
1. le mouvement des LD cytosoliques rapproche les deux LD.
2. Les protéines CIDE à la surface du LD sont progressivement enrichies au niveau du MCS LD/LD, i.e. condition préalable à la formation des MCS qui dépend largement des interactions CIDE-CIDE.
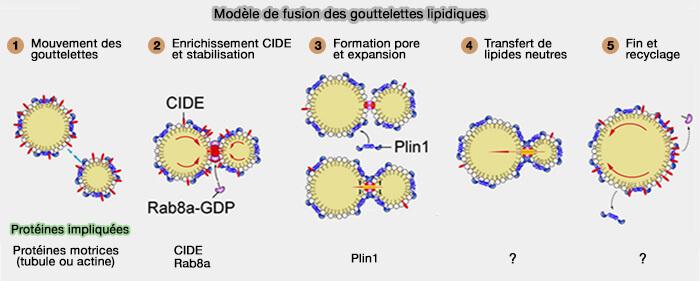
(Figure : vetopsy.fr d'après Chen et coll)
3 Lors de l'enrichissement, les protéines CIDE recrutent d'autres protéines dans les MCS et forment une structure potentielle de type pore/canal, qui permet un échange lipidique neutre entre les LD.
- Plin1 améliore la fusion et la croissance des LD médiées par le Cidec, probablement en élargissant cette formation de pores/canaux.
- Rab8a pour stabiliser cette cette structure.
4 La formation du pore de fusion permet le transfert de lipides neutres du donneur vers les LD accepteurs en raison de la différence de pression interne entre la paire LD interconnectée et la tension superficielle LD.
5. Dès que la fusion LD est terminée, le complexe structurel se désassemble, entraînant la redistribution des protéines CIDE vers la surface LD (Figure 4B).
Retour vers la lipolyse adipocytaire
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


