Lipides
Acides gras
Oxylipines
Cytochrome P450 (CYP) : réactions
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- acides gras (FA)
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques (LD)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les réactions catalytiques des cytochromes P450 (CYP) sont complexes et nécessitent l'hème comme cofacteur pour le métabolisme des lipides et des médicaments.
Les CYP font partie des trois voies enzymatiques principales impliquées dans la synthèse des eicosanoïdes, les deux autres étant (The Biosynthesis of Enzymatically Oxidized Lipids 2020) :
- les cyclooxygénases (COX),
- les lipoxygénases (LOX).
Réactions catalytiques des CYP
Réaction générale
1. De nombreuses réactions des CYP dépendent de leur capacité, en raison du groupe thiolate-hème, à catalyser la scission du dioxygène et à incorporer l'un des atomes d'oxygène dans le substrat, l'autre étant réduit en eau.
$\ce{R + O2 + NADPH}$ $\leftrightharpoons$ $\ce{RO + H2O + NADP+}$
Cette réaction est opposée à celle des dioxygénases, comme les lipoxygénases (LOX) par exemple :
$\ce{R + O2}$ $\leftrightharpoons$ $\ce{RO2}$ ou $\ce{R + R' + O2}$ $\leftrightharpoons$ $\ce{RO + RO'}$
2. Les substrats endogènes du P450 comprennent principalement :
- des lipides, i.e. stéroïdes, lanostérol, acides biliaires, eicosanoïdes et autres médiateurs lipidiques,
- des acides gras,
- des produits de dégradation de l'hème.
| Principales réactions des CYP | ||
|---|---|---|
| C-hydroxylation aliphatique |
R-CH3 | R-CH2OH |
| C-hydroxylation aromatique |
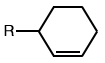 |
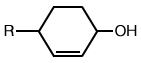 |
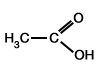
| C-oxydation | 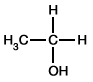 |
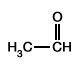 |
| C-oxydation |  |
 |
| N-O-S désalkylation | R-(NH,O,S)-CH3 | R-(NH2,OH,SH) + CH2O |
| Déméthylation (éthers) |
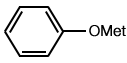 |
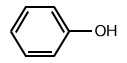 |
| Époxydation | 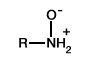 |
|
| N-hydroxylation |  |
|
| Sulfoxydation | images/png/ | |
|
… | … |
3. Les CYP catalysent un grand nombre de réactions dont les plus courantes sont (The catalytic cycle of cytochrome P450: a fascinating choreography 2021) :
- l'hydroxylation, aussi bien sur le C-hydroxylation que N ou S-hydroxylation,
- l'oxydation,
- la désalkylation, retrait d'un groupe CH3,
- l'époxydation,
- la migration de groupe (Unusual properties of the cytochrome P450 superfamily 2013).

Vous pouvez consulter ce tableau.
4. La famille CYP4, appelée aussi cytochrome P450 omega hydroxylases, favorise l'hydroxylation par rapport à l'époxydation, en particulier la ω-hydroxylation, i.e. hydroxylation à l'extrémité méthyle des acides gras ((CYP4 Enzymes as potential drug targets: focus on enzyme multiplicity, inducers and inhibitors, and therapeutic modulation of 20-hydroxyeicosatetraenoic acid (20-HETE) synthase and fatty acid ω-hydroxylase activities 2014 et The Crystal Structure of Cytochrome P450 4B1 (CYP4B1) Monooxygenase Complexed with Octane Discloses Several Structural Adaptations for ω-Hydroxylation 2017).
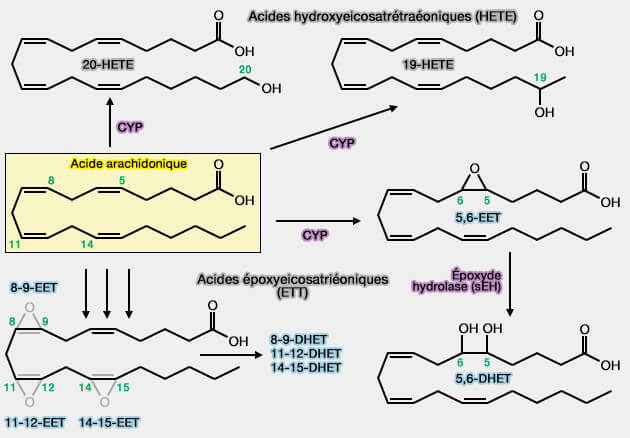
a. L'hydroxylation terminale des FA par les CYP produit de l'acide 20-hydroxyeicosatétraénoïque (20-HETE), qui joue un rôle dans la régulation de la pression artérielle et l'équilibre hydrique, mais aussi dans la tumorisation (20-HETE and Blood Pressure Regulation 2014).
b. De plus, l'hydroxylation terminale fonctionne dans la ω-oxydation, une voie catabolique des FA alternative à celle de la β-oxydation), la dégradation de certains eicosanoïdes (prostaglandines, leucotriènes) et la formation appropriée de la barrière de perméabilité cutanée (Essential role of the cytochrome P450 CYP4F22 in the production of acylceramide, the key lipid for skin permeability barrier formation 2015).
c. L'hydroxylation de la chaîne intermédiaire des acides gras polyinsaturés (PUFA) produit des dérivés mono-hydroxylés (HETE dans le cas des FA) avec diverses bioactivités (Human cytochromes P450 in health and disease 2013).
(Figure : vetopsy.fr)
5. L'époxydation par les CYP produit avec (Cytochrome P450 epoxygenase pathway of polyunsaturated fatty acid metabolism 2015) :
- les FA des acides époxy-eicosatriénoïques (EET).
- LA (acide lonlénique), EPA (acide eicosapentaénoique) et DHA (acide docosahexaénoique) des dérivés époxy impliqués dans la régulation de la pression artérielle et l'inflammation.
Leur métabolisme est assuré par plusieurs époxyde hydrolases (EC 3.3.2.9) notamment l'époxyde hydrolase microsomale (mEH ou EPHX1) ou l'époxyde hydrolase soluble (sEH ou EPHX2) qui produisent des dérivés dihydroxy qui possèdent des bioactivités différentes de celles de leurs précurseurs époxyde( Role of epoxide hydrolases in lipid metabolism 2014).
6. Les CYP catalysent de nombreuses réactions dans le métabolisme des stérols, dont la déméthylation du lanostérol par le CYP51A1 pour la synthèse du cholestérol et bien d'autres encore dans :
- la synthèse des acides biliaires,
- la synthèse des hormones stéroïdiennes,
- la synthèse d'oxystérols.

Le tableau suivant a été repris de : Cytochrome P450 de Wikipedia.
| Famille | Fonction | Membres | Génes | Pseudogénes |
| CYP1 |
|
|
CYP1D1P | |
| CYP2 | Métabolisme médicaments et stéroïdes |
|
Trop nombreux |
|
| CYP3 | Métabolisme médicaments et stéroïdes (testostérone) |
|
CYP3A4, CYP3A5, CYP3A7, CYP3A43 |
|
| CYP4 | Métabolisme de l'acide arachidonique et des acides gras |
|
Trop nombreux |
|
| CYP5 | Thromboxane A2 synthase (TBXAS1) |
|
CYP5A1 | |
| CYP7 |
|
|
||
| CYP8 | Variée |
|
|
|
| CYP11 | Biosynthèse des stéroïdes |
|
||
| CYP17 |
|
|
CYP17A1 | |
| CYP19 |
|
CYP19A1 | ||
| CYP20 | ? |
|
CYP20A1 | |
| CYP21 | Biosynthèse des stéroïdes |
|
CYP21A2 | CYP21A1P |
| CYP24 | Dégradation |
|
CYP24A1 | |
| CYP26 | Hydroxylase acide rétinoïque |
|
||
| CYP27 | Variée |
|
|
|
| CYP39 | 7-alpha hydroxylation (24-hydroxy- cholestérol) |
|
CYP39A1 | |
| CYP46 |
|
|
CYP46A1 | CYP46A4P |
| CYP51 | Biosynthèse du cholestérol |
|
CYP51A1 (lanostérol 14-alpha deméthylase) |
|
Source d'électrons
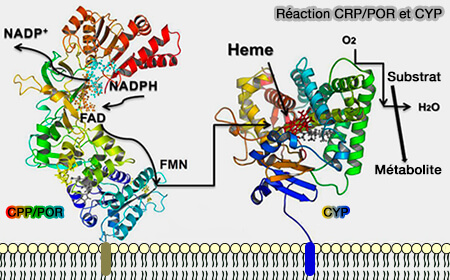
Ces réactions nécessitent une source d'électrons provenant d'une chaîne de transfert d'électrons de différentes sources avec lesquelles les CYP forment des complexes pendant la catalyse (Redox Partners: Function Modulators of Bacterial P450 Enzymes 2020).
1. Dans le réticulum endoplasmique (RE) des systèmes eucaryotes, les électrons proviennent de l'oxydation du NADPH par la NADPH cytochrome P450 oxydoréductase (CPR), appelée aussi réductase (CPR) du réticulum endoplasmique (RE), qui transfère ensuite l'électron vers le P450.
(Figure : vetopsy.fr d'après Parween et coll)
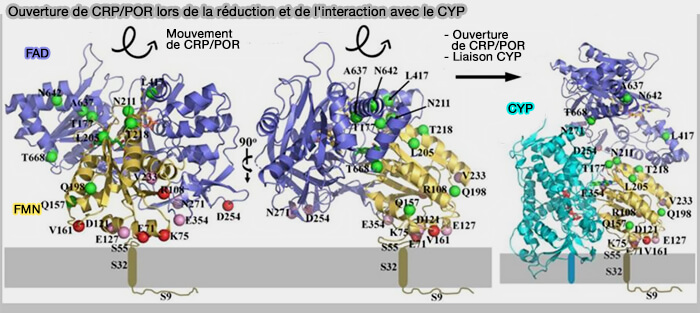
a. POR est un polypeptide contenant une molécule de FAD (Flavine Adénine Dinucléotide) et une molécule de FMN (Flavine MonoNucléotide) qui existe sous forme fermée ou ouverte selon la phase du cycle redox.
b. Le mécanisme serait le suivant.
- Lors de la réduction des flavines dans le CPR par NADPH, la protéine subit un léger degré d'ouverture. Puis, la conformation ouverte est stabilisée par la liaison au CYP, permettant le transfert d'électrons du FMN exposé vers l'hème du CYP.

Vous pouvez suivre les transformations de POR dans : Structural and Functional Studies of the Membrane Binding Domain of NADPH -Cytochrome P450 Oxidoreductase (2019) et Membrane-attached mammalian cytochromes P450: An overview of the membrane's effects on structure, drug binding, and interactions with redox partners (2018).
2. Dans les mitochondries, c'est la ferrédoxine (FDX) et la ferrédoxine réductase (FDXR) qui interviennent, i.e. appelées aussi adrénoxine et adrénoxyl-réductase (
(Figure : vetopsy.fr d'après Xia et coll)
Remarque : toutefois, toutes les réactions CYP ne nécessitent pas de donneurs externes d’oxygène ou d’électrons comme, par exemple, dans les réactions d'isomérisation catalysées par le CYP5A1 (thromboxane A synthase) et le CYP8A1 (prostacycline synthase).
Mécanisme des CYP

Vous pouvez lire : Mechanisms of Cytochrome P450-Catalyzed Oxidations 2018 et Reductive Cytochrome P450 Reactions and Their Potential Role in Bioremediation 2021.
Le mécanisme général des CYP comprend plusieurs étapes et les intermédiaires suivant la liaison de l’$\ce{O2}$ jusqu’au composé I sont difficiles à caractériser en raison de leur instabilité, i.e. les structures électroniques exactes ne sont pas entièrement validées.
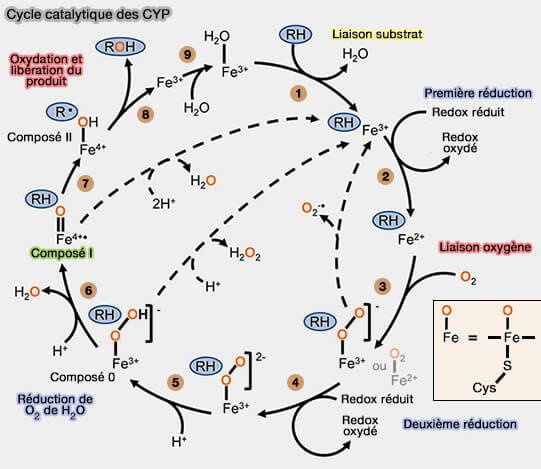
1. Néanmoins, les étapes seraient les suivantes, en commençant avec l’enzyme à l’état de repos, i.e. resting state en anglais, dans lequel un ligand d'eau ($\ce{H2O}$) occupe le site actif et le fer héminique est à l’état ferrique ($\ce{Fe+++})$.
- 1. La liaison du substrat ($\ce{RH}$) déplace la molécule d'eau.
- 2. Elle est suivie d'une réduction d'un électron du fer héminique de $\ce{Fe+++}$ à $\ce{Fe++}$.
- 3. Cette réduction permet à l'oxygène moléculaire ($\ce{RH}$) de se lier à l'hème ferreux pour former un intermédiaire peroxo-ferrique (ou ferreux selon les auteurs).
- 4. Une deuxième réduction d'un électron crée un intermédiaire peroxo-ferrique, complexe de fer (Fe), typiquement $\ce{Fe+++}$ et un groupe peroxo $\ce{O2^{--}}$ lié à ce métal.
(Figure : vetopsy.fr d'après Behrendorf)
- 5. Cet intermédiaire est rapidement protoné en une espèce hydroperoxo-ferrique, i.e. ces deux derniers intermédiaires peuvent aussi être appelés composés 0.
- 6. Une deuxième protonation entraîne la libération d’eau et la formation du radical oxoferryl avec le fer sous forme d'ion perferryle $\ce{Fe++++})$ hautement réactif connu sous le nom de composé I (Ferryl Protonation in Oxoiron(IV) Porphyrins and Its Role in Oxygen Transfer 2015 et The mystery of cytochrome P450 Compound I 2011).
- 7. Le composé I extrait un atome d'hydrogène du substrat, formant brièvement un hydroxyferryl.
- 8. Cet intermédiaire se recombine avec le radical de substrat hautement réactif résultant de l'abstraction de protons qui produit la monooxygénation du substrat.
- 9. Une molécule d'eau ramène le fer héminique à l’état ferrique.

(Figure : vetopsy.fr d'après Behrendorf)
2. Le cycle catalytique P450 peut se découpler (flèches pointillées) après l'une ou l'autre des étapes de réduction à un électron, entraînant la libération d'oxygène réduit sous forme de superoxyde ou de peroxyde d'hydrogène.
L'hydroxyde du ferryl peut également être protoné pour provoquer un découplage et une libération d'eau sans métabolisme du substrat.
Retour vers les eicosanoïdes
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesacides gras (FA)Synthèse des acides grasβ-oxydationCorps cétoniquesOxylipinesLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesGlycérophospholipidesSphingophospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


