Système endo-lysosomal
Complexe ESCRT
ESCRT-II et recrutement de ESCRT-III
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le complexe ESCRT est composé de 5 complexes impliqués pendant les évènements de remodelage de la membrane cellulaire, dont ESCRT-II, qui recrute ESCRT-III. ALIX et HD-PTP peuvent le remplacer dans cette fonction.
Le complexe ESCRT (Endosomal Sorting Complex Required for Transport ou complexe de tri endosomal requis pour le transport) est composé de 5 complexes :
- ESCRT-0,
- ESCRT-I,
- ESCRT-II,
- ESCRT-III,
- Vps4 (Vacuolar Protein Sorting 4) qui contient un domaine catalytique AAA+ ATPase.
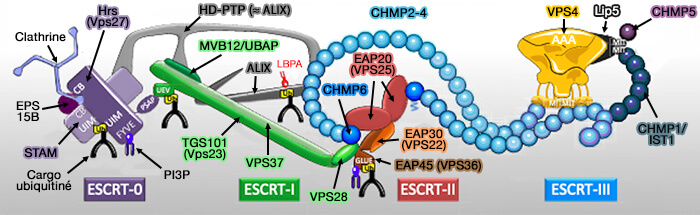
(Figure : vetopsy.fr d'après Christ et Hill)
ESCRT-II
Structure du complexe ESCRT-II
1. ESCRT-II, hétérotétramère en forme de Y, est recruté par ESCRT-I et composé par (Endosome-Associated Complex, ESCRT-II, Recruits Transport Machinery for Protein Sorting at the Multivesicular Body 2002 et Integrated Structural Model and Membrane Targeting Mechanism of the Human ESCRT-II Complex 2008).
- deux sous-unités EAP20 (VPS25),
- une sous-unité EAP30 (VPS22),
- une sous-unité EAP45 (VPS36).
2. Toutes ses sous-unités contiennent deux domaines WH (Winged Helix) en tête-bêche qui se superposent dans la structure.
3. EAP30/VPS22 et EAP45/VPS36 sont intimement liés, quatre et trois premières hélices respectivement, formant un vaste domaine hélicoïdal (HD) qui est le plus mobile de ESCRT-II.
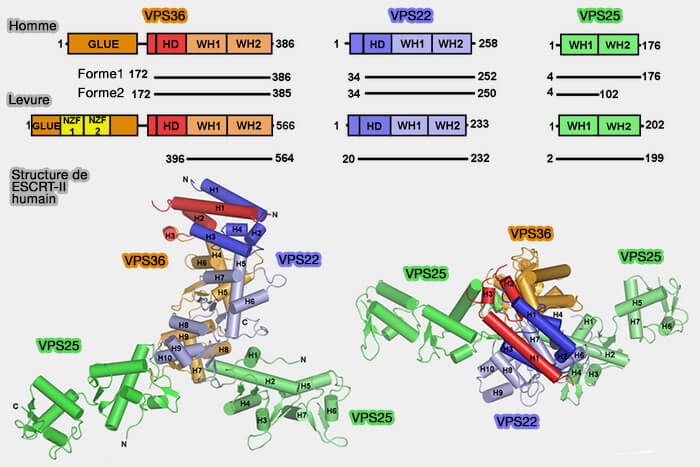
(Figure : vetopsy.fr d'après Jun Im et Hurley)
EAP20/VPS25
1. Les deux sous-unités EAP20/VPS25 forment les deux branches du Y.
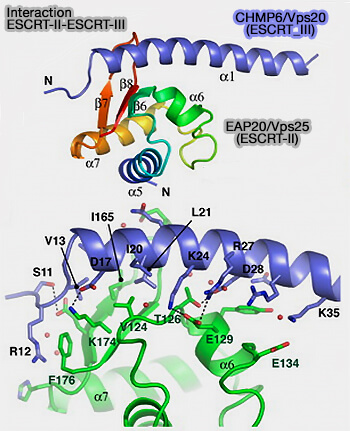
(Figure : vetopsy.fr d'après Im et coll)
2. Elles interagissent directement, par le domaine WH2 de leur partie C-terminale, avec le domaine N-terminal de la protéine CHMP6, homologue de Vps20 de la levure du complexe ESCRT-III (Structure and Function of the ESCRT-II-III Interface in Multivesicular Body Biogenesis 2009 et Human CHMP6, a myristoylated ESCRT-III protein, interacts directly with an ESCRT-II component EAP20 and regulates endosomal cargo sorting 2005).
EAP45/VPS36
La sous-unité EAP45/VPS36 de l'ESCRT-II est impliquée dans plusieurs liaisons, en particulier par le domaine GLUE chez l'homme.
1. Elle se lie au domaine C-terminal de la sous-unité VPS28 de l'ESCRT-I.
- par une hélice C-terminale au domaine GLUE (GRAM-Like Ubiquitin-binding de EAP45 ) chez l'homme,
- par le domaine NZF1 de la levure (Integrated Structural Model and Membrane Targeting Mechanism of the Human ESCRT-II Complex 2008).
2. Elle entre en interaction avec l'ubiquitine :
- le long d'un bord du β-sandwich de son domaine GLUE chez l'homme (Structural basis for ubiquitin recognition by the human ESCRT-II EAP45 GLUE domain 2006 et Integrated Structural Model and Membrane Targeting Mechanism of the Human ESCRT-II Complex 2008),
- par le domaine NZF2 comme chez la levure
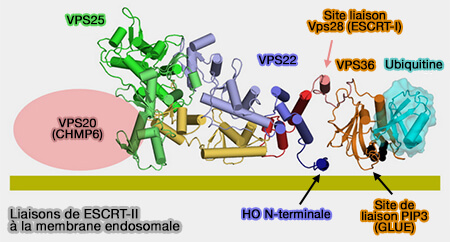
(Figure : vetopsy.fr d'après Jun Im et Hurley)
3. Le domaine GLUE se lie aussi aux phosphoinositides des membranes endosomales, i.e. en particulier à PI(3)P .
GLUE ressemble à un domaine PH avec une poche lipidique non canonique (ESCRT-I Core and ESCRT-II GLUE Domain Structures Reveal Role for GLUE in Linking to ESCRT-I and Membranes 2006).
EAP30/VPS22
La première hélice de EAP30/VPS22 cible également les phosphoinositides des membranes endosomales.

Le recrutement des complexes ESCRT-I et ESCRT-II va induire la déformation et le bourgeonnement de la membrane endosomale.
Recrutement de ESCRT-III

Dans les cellules de mammifères, ESCRT-I/II et ALIX sont deux points d'entrée partiellement redondants vers la scission membranaire médiée par ESCRT dans :
- la biogenèse des vésicules intraluminales (ILV) et des endosomes ou corps multivésiculaires (MVE/MVB),
- la cytokinèse,
- le bourgeonnement viral.
ESCRT-I-II
1. La première voie utilise le complexe ESCRT-I/II très flexible pour recruter ESCRT-III vers les sites de scission en interagissant sur CHMP6 par plusieurs liaisons (ESCRT-II coordinates the assembly of ESCRT-III filaments for cargo sorting and multivesicular body vesicle formation 2010).
- VPS28 de ESCRT-I interagit avec CHMP6/Vps20 (The Crystal Structure of the C-Terminal Domain of Vps28 Reveals a Conserved Surface Required for Vps20 Recruitment 2006 et Integrated Structural Model and Membrane Targeting Mechanism of the Human ESCRT-II Complex 2008).
- Les deux sous-unités EAP20/VPS25 de ESCRT-II imposent une orientation différente aux deux CHMP6 (Human CHMP6, a myristoylated ESCRT-III protein, interacts directly with an ESCRT-II component EAP20 and regulates endosomal cargo sorting 2005).
On pensait que l'affinité d'ESCRT-I et -II l'un pour l'autre en faisait des partenaires obligatoires, mais on sait maintenant qu'ESCRT-II a un rôle direct dans la cytokinèse (ALIX and ESC RT-I/II function as parallel ESC RT-III recruiters in cytokinetic abscission 2016 et Inhibition of ESCRT-II–CHMP6 interactions impedes cytokinetic abscission and leads to cell death 2014).
(Figure : vetopsy.fr d'après Pires et Gahloth)
2. Le supercomplexe ESCRT-I/II se colocalise au col vésiculaire en bourgeonnement et forme un assemblage de protéines en forme de selle, i.e. convexe par rapport à un axe et concave par rapport à l'autre (Molecular Mechanism of Multivesicular Body Biogenesis by ESCRT Complexes 2010) .
ALIX
ALIX (Apoptosis-Linked gene-2 Interacting protein X, BRO1 ou PDCD6IP) est utilisé pour la deuxième voie (Etude du rôle de la protéine ALIX dans l’endocytose 2015).

Vous pouvez lire : Étude du rôle de la protéine ALIX dans l’endocytose (2015) ) et Etudes structurales et fonctionnelles de la protéine ALIX (2015).
ALIX assure la médiation du tri ESCRT des récepteurs couplés aux protéines G (GPCR) comme (Endo-lysosomal sorting of G-protein-coupled receptors by ubiquitin: Diverse pathways for G-protein-coupled receptor destruction and beyond 2019) :
- PAR1, Protease-Activated Receptor (ALIX binds a YPX 3 L motif of the GPCR PAR1 and mediates ubiquitin-independent ESCRT-III/MVB sorting 2012),
- le récepteur purinergique P2Y1 (ALIX Regulates the Ubiquitin-Independent Lysosomal Sorting of the P2Y1 Purinergic Receptor via a YPX3L Motif 2016).
ALIX intervient aussi dans la voie synténine/ALIX pour le ciblage spécifique d’une protéine transmembranaire dans les vésicules intraluminales (ILV) des endosomes ou corps multivésiculaires (MVE/MVB).
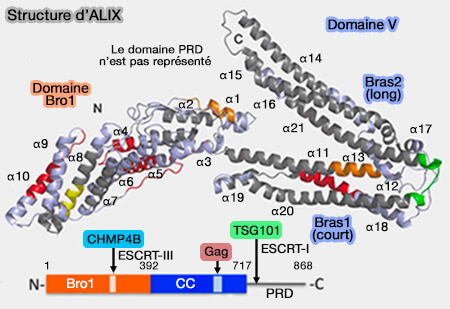
Structure d'ALIX
ALIX, qui fonctionne comme un homodimère, 1. est une protéine de 568 résidus constituée de trois domaines.
Domaine Bro1 N-terminal
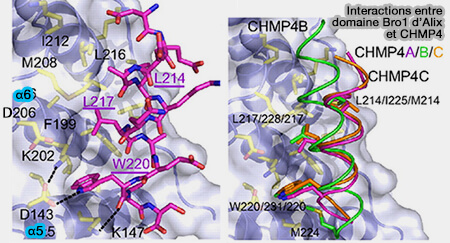
Interactions Bro1 d'ALIX et CHMP4
(Figure : vetopsy.fr d'après McCullough et coll)
Le domaine Bro1 N-terminal est incurvé et se lie à l'hélice C-terminale de la protéine CHMP4 de ESCRT-III sur un site de sa face concave, entre α5 et α6.
Le domaine Bro1 est étudié dans : Structural Basis for Endosomal Targeting by the Bro1 Domain (2005), ALIX-CHMP4 interactions in the human ESCRT pathway (2008) et Structure of the Bro1 Domain Protein BROX and Functional Analyses of the ALIX Bro1 Domain in HIV-1 Budding (2011).
Domaine V central
Le domaine V central, appelé ainsi car il forme la lettre V, est composé de 11 hélices α, i.e. α11 à 21 sur la figure (Structural basis for viral late domain binding to ALIX 2008 et Structure-based in silico identification of ubiquitin-binding domains provides insights into the ALIX-V:ubiquitin complex and retrovirus budding 2013).
- Le bras court (75 Å) contient l'extrémité N-terminale et comprend six hélices (α11, α12, α17, α18, α19, α20) et 150 résidus.
- Le bras long (100 Â) contient l'extrémité C-terminale, cinq hélices (α13, α14, α15, α16, α21) et 194 résidus.
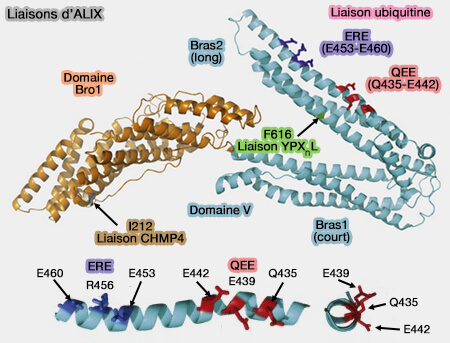
Liaisons d'ALIX
(Figure : vetopsy.fr d'après Dowlatshahi et coll)
1. Une poche hydrophobe profonde et étendue est située sur le bras long et fait face à l'espace entre les deux bras du V.
Cette poche, qui contient Phe676, permet la liaison avec le motif LYPXnLXXL, en particulier de p6 du HIV (The N-Terminus of the HIV-1 p6 Gag Protein Regulates Susceptibility to Degradation by IDE 2018).
2. Deux sites de liaison à l'ubiquitine (QEE et ERE chez l'homme) sont situés sur une seule surface α-hélicoïdale du domaine V (ALIX Is a Lys63-Specific Polyubiquitin Binding Protein that Functions in Retrovirus Budding 2012 et The yeast ALIX homolog, Bro1, functions as a ubiquitin receptor for protein sorting into multivesicular endosomes 2013).
3. On trouve des sites de liaison à la synténine (
Domaine PRD C-terminal
1. Le domaine PRD, riche en proline, C-terminal, se lie à de nombreux partenaires :
- la protéine TSG101, une sous-unité du complexe ESCRT-I par un motif P[T/S]AP,
- des partenaires à domaine SH3 par plusieurs motifs P748xRPPPP761 comme les endophilines, mais aussi ALG-2 (Apoptosis-Linked Gene-2) (ALG-2 activates the MVB sorting function of ALIX through relieving its intramolecular interaction 2015),
- l’ubiquitine ligase Nedd-4 par deux motifs PPxY (723-726 et 835-838).
2. Le domaine riche en proline (PRD) C-terminal auto-inhibe le domaine V (Activation of the Retroviral Budding Factor ALIX 2011 et Proline-rich domain of human ALIX contains multiple TSG101-UEV interaction sites and forms phosphorylation-mediated reversible amyloids 2020).
Activation d'ALIX
1. ALIX adopte un état auto-inhibé dans le cytosol.
- Les deux bras du domaine V adoptent une conformation " fermée ".
- Le PRD se replie sur le domaine V, i.e. pour occlure le site de liaison LYPXnLXXL sur le domaine Bro1.
2. L'activation d'ALIX nécessite la dissociation du PRD du noyau Bro1-V, l'ouverture du domaine V et la dimérisation de la protéine.
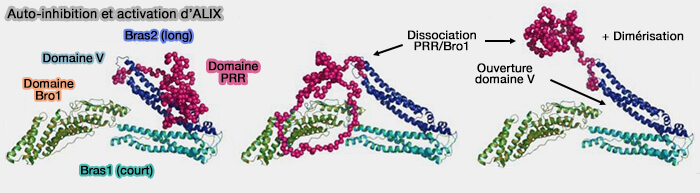
(Figure : vetopsy.fr d'après Zhai et coll)

ALIX dimérisé, avec ses domaines Bro1 liés à CHMP4, ressemble à ESCRT-II avec ses deux sous-unités EAP20/VPS25 qui interagissent directement avec les molécules de CHMP6.
HD-PTP
HD-PTP (Histidine Domain PhosphoTyrosine Phosphatase) est une protéine de type ALIX qui peut la remplacer dans le recrutement de CHMP4 (Recruitment of UBPY and ESCRT Exchange Drive HD-PTP-Dependent Sorting of EGFR to the MVB 2013 et The open architecture of HD-PTP phosphatase provides new insights into the mechanism of regulation of ESCRT function 2017).
HD-PTP est nécessaire pour la down-régulation :
- du récepteur EGF (The Bro1-related protein HD-PTP/PTPN23 is required for endosomal cargo sorting and multivesicular body morphogenesis 2008),
- du récepteur PDGF (Histidine-domain-containing protein tyrosine phosphatase regulates platelet-derived growth factor receptor intracellular sorting and degradation 2015),
- de l'intégrine α5β1 (Interplay of Endosomal pH and Ligand Occupancy in Integrin α5β1 Ubiquitination, Endocytic Sorting, and Cell Migration 2015).
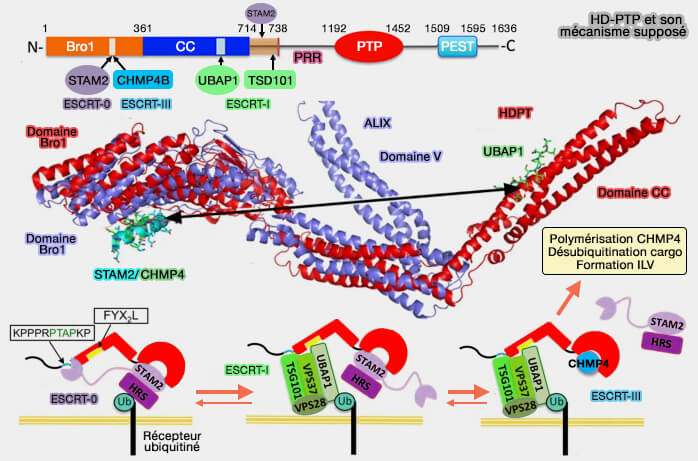
(Figure : vetopsy.fr d'après Gahloth et coll)
ESCRT-III
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


