Lipides
Trafic non vésiculaire
LTP ou protéines de transfert des lipides
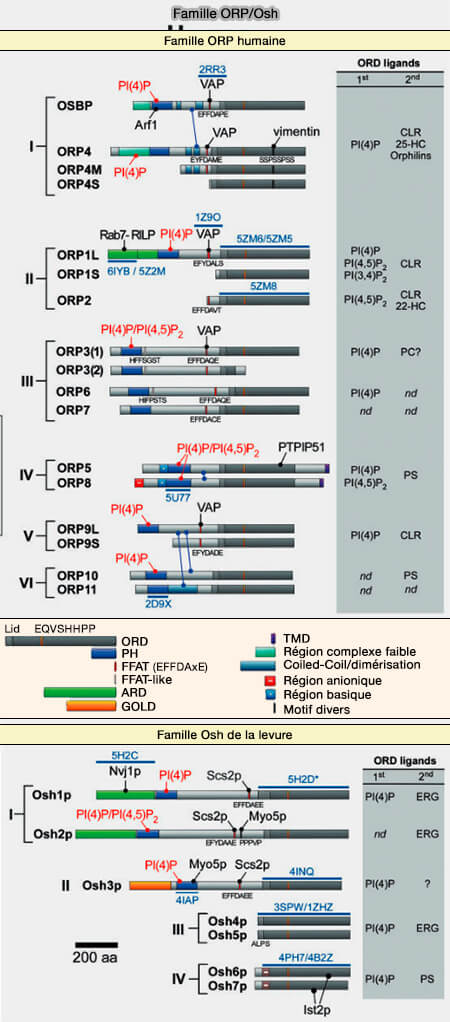
Famille ORP/Osh
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les membres de la famille ORP/Osh, protéines de transfert des lipides (LTP ou Lipid Tranfer Protein) impliquées dans leur trafic non vésiculaire par navette, régulent l'homéostasie des phospholipides (PL), du cholestérol et des oxystérols.
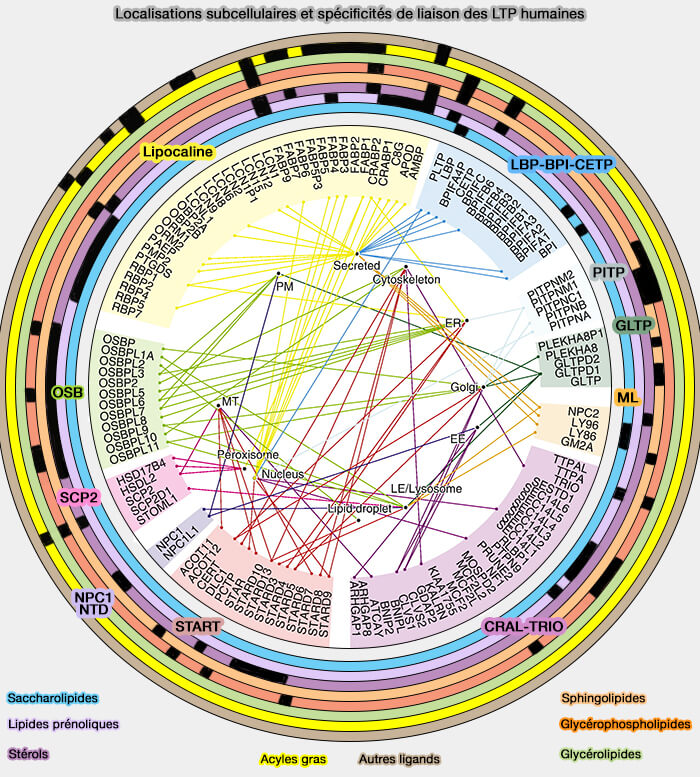
(Figure : vetopsy.fr d'après Chiapparino et coll)
1. Les LTP intracellulaires se localisent sur les sites de contact membranaire (MCS) au sein desquelles les LTP peuvent transférer les lipides d'un compartiment donneur à un compartiment accepteur (Lipid transfer proteins: the lipid commute by shuttles, bridges and tubes 2019).
2. Les LTP peuvent remplir au moins l'une des trois fonctions principales dans les cellules en agissant comme (
- transporteurs pour transférer des lipides entre les membranes,
- chaperons pour présenter des lipides à une protéine acceptrice, i.e. enzymes, autres LTP, transporteurs transmembranaires ou facteurs de transcription,
- capteurs (détecteurs) pour modifier une interaction avec d'autres protéines en réponse à la liaison ou à la libération d'un lipide.
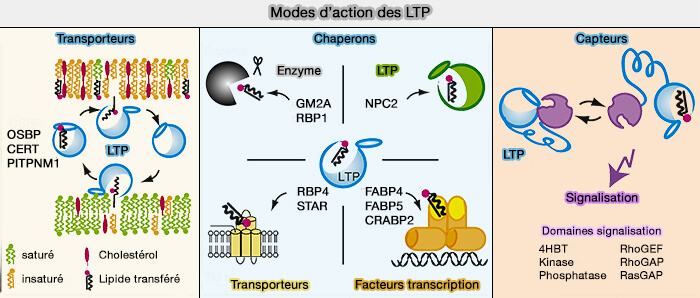
(Figure : vetopsy.fr d'après Chiapparino et coll)
Les membres de la famille ORP/Osh, i.e. Oxysterol-binding proteins(OSBP)-Related Proteins mammaliennes et OsBP-homolog de la levure, régulent l'homéostasie des phospholipides (PL), du cholestérol et les oxystérols au niveau des sites de contact membranaire (MCS) entre le réticulum endoplasmique (RE) et :

Vous pouvez lire : Structural and Functional Specialization of OSBP-Related Protein (2020)
Structure générale et rôles de la famille des ORP/Osh
1. Les ORP contiennent tous au moins :
- un domaine PH (Pleckstrin Homology) pour se lier aux phosphoinositides,
- un domaine ORD (OSBP-Related Domain) conservé C-terminal.
Le domaine FFAT se lie aux protéines VAP (VAMP-Associated Protein) du réticulum endoplasmique (RE), mais n'est pas présent chez ORP10 et ORP11.
2. Le domaine ORD (OSBP-Related Domain) possède un tunnel hydrophobe central de liaison au ligand de 1600 Å3, avec un couvercle flexible couvrant l'entrée du tunnel, qui peut accueillir une seule molécule de cholestérol, d'oxystérol ou de phospholipides (Structure of human ORP3 ORD reveals conservation of a key function and ligand specificity in OSBP-related proteins 2021).
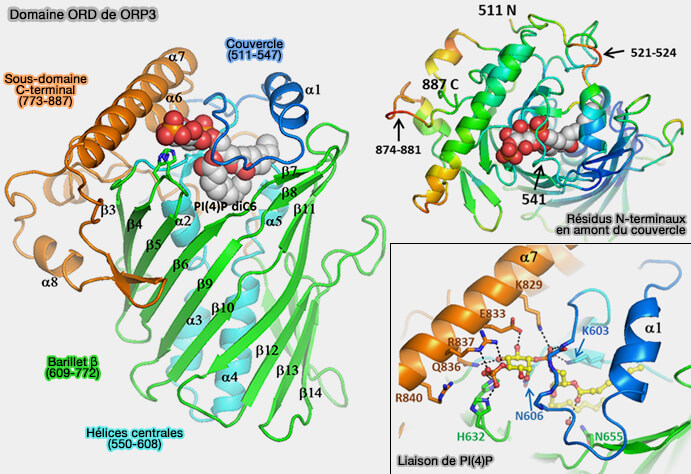
(Figure : vetopsy.fr d'après Tong et coll)
a. Le noyau ORD est constitué d'un feuillet β antiparallèle centrale de 20 brins qui forme un tonneau β incomplet flanqué par :
- un sous-domaine N-terminal (résidus 550–608) à l'intérieur du tonneau est constitué d'un feuillet β à deux brins et de quatre hélices α qui forment un faisceau antiparallèle,
- un grand sous-domaine C-terminal (résidus 773–887). à quatre hélices α et deux brins β formant une épingle à cheveux, les résidus 874-881 forment une région désordonnée.
b. Les résidus 511-547 forment un couvercle (lid en anglais) recouvrant l'ouverture du tunnel, le couvercle proprement dit est constitué par les résidus 525-545.
- Il contient deux tours d'une hélice α amphipathique.
- Les résidus en amont du couvercle (résidus 510 à 524) forment une boucle étendue sur la surface concave de la région C-terminale.
c. La fermeture du couvercle, i.e. ORP3 avec PI(4)P est effectué par des interactions hydrophobes avec l'entrée du tunnel (
3. OSBP, comme semble-t-il, d'autres ORP/Osh, contient une région intrinsèquement désordonnée (IDR) N-terminale de 90 résidus qui contrôle l'orientation et la dynamique de l'OSBP au niveau des MCS RE-Golgi et empêche son attachement avorté homotypique Golgi-Golgi (An Intrinsically Disordered Region in OSBP Acts as an Entropic Barrier to Control Protein Dynamics and Orientation at Membrane Contact Sites 2019)..
Les IDR dans les protéines solubles ou liées à la membrane pourraient également jouer un rôle dans le contrôle de la ségrégation, de la dynamique et de l'orientation des protéines dans ou à proximité d'environnements membranaires surpeuplés (
Rôles de la famille des ORP/Osh

Le transport de ces ligands semble être la fonction principale des ORP, mais ils servent aussi de capteur lipidique.
Les ORP, présent dans les sites de contact membranaire (MCS) facilitent un mécanisme de " contre-transport " de transfert de lipides bidirectionnel, en utilisant un gradient de phosphoinositides pour conduire le transfert de lipides courants (Functions of Oxysterol-Binding Proteins at Membrane Contact Sites and Their Control by Phosphoinositide Metabolism 2021).
(Figure : vetopsy.fr d'après Delfosse et coll)
Cela a été démontré pour :
- le transport phosphatidylsérine (PS))contre PI(4)P aux MCS RE/MP par ORP5 et ORP8,
- le transport PI(4,5)P2/PI(3,4)P2, en plus de PI(4)P pour ORP2, ORP5 et ORP8 (ORP2 Delivers Cholesterol to the Plasma Membrane in Exchange for Phosphatidylinositol 4, 5-Bisphosphate (PI(4,5)P2) 2019 et ORP5 and ORP8 bind phosphatidylinositol-4, 5-biphosphate (PtdIns(4,5)P 2) and regulate its level at the plasma membrane 2017).
Classification des ORP
La famille ORP de 15 membres est divisée en sous-familles I à VI en fonction de l'homologie des acides aminés (The Diverse Functions of Oxysterol-Binding Proteins 2010 et Functions of Oxysterol-Binding Proteins at Membrane Contact Sites and Their Control by Phosphoinositide Metabolism 2021).
Remarque : la famille Osh des levures, homologue des ORP, contient 7 membres, Osh1-7.
Sous-famille I
La sous-famille I comprend deux membres.
1. OSBP (OSBP1) contrôle les échanges de cholestérol entre le RE et le réseau trans-Golgi (TGN) dépendent du taux de PI(4)P (

OSBP (Oxysterol-binding protein) est étudiée dans un chapitre spécial.
2. ORP4 (OSBP2) capte les oxystérols pour inhiber leur cytotoxicité.
Sous-famille II
La sous-famille II comprend deux membres.
1. ORP1 ou OSBPL1 (Oxysterol-binding protein-related protein1) est présent sous deux isoformes.
a. ORP1L, forme longue, est un capteur de cholestérol ancré dans les endosomes/lysosomes qui peut :
- déplacer le cholestérol de manière bidirectionnelle à l'interface avec le réticulum endoplasmique (
trafic rétrograde (centripète) des endosomes/lysosomes),
- contribuer à la maturation des autophagosomes, ou
- intervenir dans la division mitochondriale, dans les contacts à trois voies.
b. ORP1S, forme courte, transporte le cholestérol vers la membrane plasmique et pourrait délivrer des oxystérols aux LXR localisés dans le noyau pour réguler positivement l'expression de l'apoE.
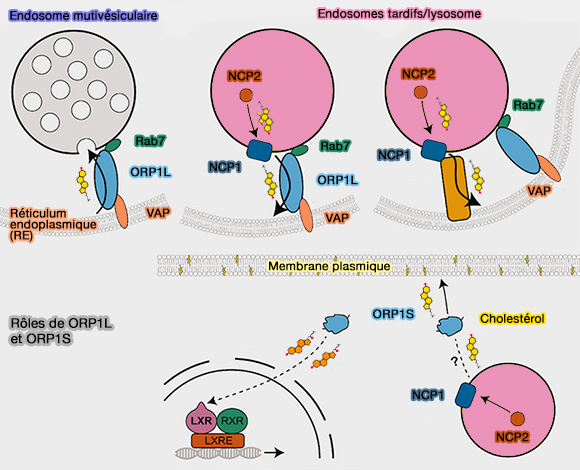
(Figure : vetopsy.fr d'après Aw et coll)
2. ORP2 (OSBPL2) délivre du cholestérol à la membrane plasmique, grâce à l'hydrolyse de PI(4,5)P2 ou PIP2 (ORP1L, ORP1S, and ORP2: Lipid Sensors and Transporters 2020).
Sous-famille III
La sous-famille II comprend trois membres (Subfamily III of mammalian oxysterol-binding protein (OSBP) homologues: the expression and intracellular localization of ORP3, ORP6, and ORP7 2004) :
1. ORP3 est localisé aux MCS RE/MP (Structure of human ORP3 ORD reveals conservation of a key function and ligand specificity in OSBP-related proteins 2021).
Il est impliqué dans (Structure of human ORP3 ORD reveals conservation of a key function and ligand specificity in OSBP-related proteins 2021) :
- le transport des lipides,
- la dynamique d'adhésion focale régulée par Ca++ et la phosphorylation dépendante de PKC (ORP3 phosphorylation regulates phosphatidylinositol 4-phosphate and Ca2+ dynamics at plasma membrane–ER contact sites 2020).
2. ORP6 est particulièrement localisé dans les MCS :
- du système nerveux central, en particulier le Lobe occipital,
- des neurones (The involvement of oxysterol-binding protein related protein (ORP) 6 in the counter-transport of phosphatidylinositol-4-phosphate (PI4P) and phosphatidylserine (PS) in neurons 2022).
3. ORP7 est peu étudié et serait particulièrement présent dans le tube digestif.
Sous-famille IV
La sous-famille IV comprend deux membres, ORP5 (OSBPL5) et ORP8 (OSBL8) qui jouent un rôle important divers sites de contacts membranaires (MCS) :
- dans l'échange en particulier de la phosphatidylsérine (PS) avec les phosphoinositides (PI4P/phosphatidylserine countertransport at ORP5- and ORP8-mediated ER–plasma membrane contacts 2015),
- mais, semble-t-il aussi, dans le transfert du cholestérol.
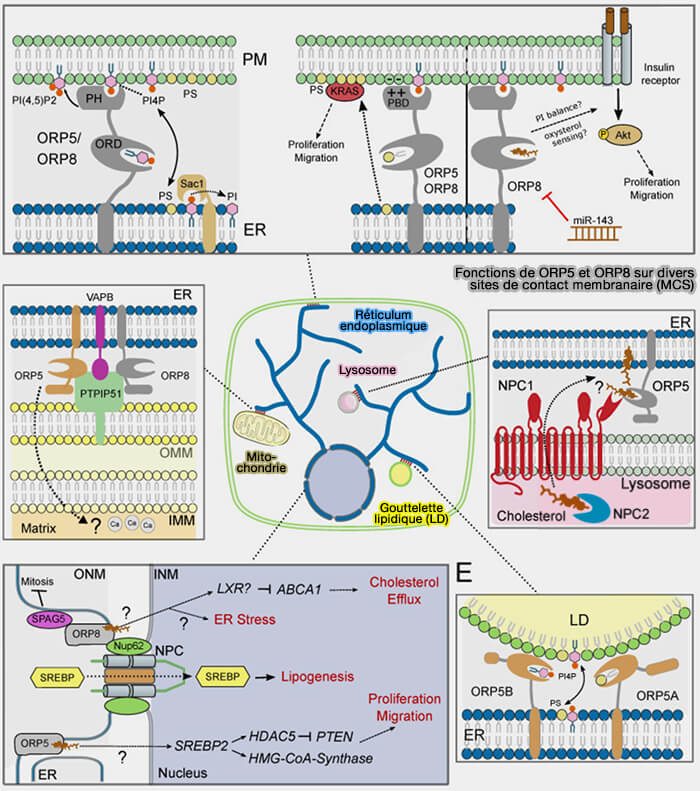
(Figure : vetopsy.fr d'après Criado Santos et coll)
Sous-famille V et VI
1. La sous-famille V comprend qu'un seul membre ORP9, avec une forme longue (ORP9L) et une forme courte (ORP9S).
2. La sous-famille VI est composée de deux membres, i.e. ORP10 et ORP11 qui ont la particularité, par rapport aux autres ORP, de ne pas posséder ;
- de domaine FFAT pour se lier aux protéines VAP (VAMP-Associated Protein) du réticulum endoplasmique (RE),
- de domaine transmembranaire.
Par contre, ils contiennent entre le domaine PH et le domaine ORD un lien contenant un domaine coiled-coil (superhélice).
3. ORP10 et ORP11 peuvent entrer en interaction avec ORP9 qui contient un motif FFA.
a. Cela a été démontré pour ORP10 qui se lie par son lien :
- aux MCS RE/endosomes (PI4P/PS countertransport by ORP10 at ER–endosome membrane contact sites regulates endosome fission 2021),
- au réseau trans-Golgi (TGN) pour l'échange de lipides, i.e. rôle redondant avec OSBP dans le maintien du contact avec le réticulum endoplasmique (RE).
b. ORP11 est également recruté dans le réseau trans-Golgi (TGN) et, dans une moindre mesure, dans les endosomes, par ORP9, l'interaction dépendant de la région de liaison des deux protéines (OSBP-related protein 11 (ORP11) dimerizes with ORP9 and localizes at the Golgi–late endosome interface 2010).
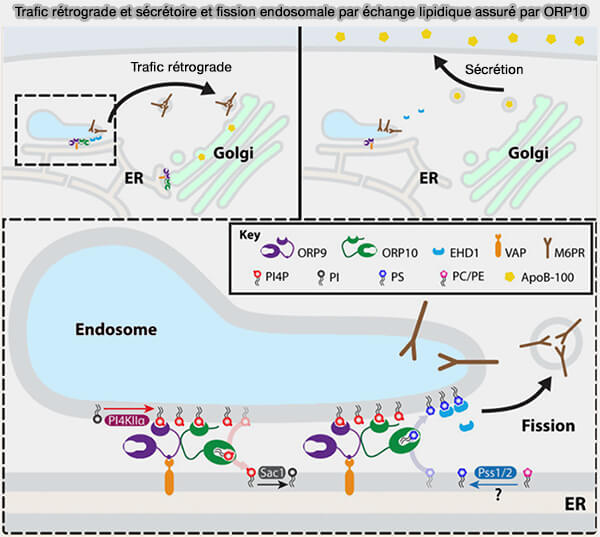
(Figure : vetopsy.fr d'après Wong et coll)
4. ORP9 et ORP10 sont impliqués dans la régulation du trafic rétrograde et sécrétoire par échange lipidique et la fission endosomale.

Vous pouvez lire : Thank ORP9 for FFAT: With endosomal ORP10, it’s fission accomplished! (2022), article dans lequel les mécanismes de la figure ci-dessous sont détaillés.
a. ORP10 interagit avec ORP9 lié aux protéines VAP (VAMP-Associated Protein) au niveau des MCS RE/endosome et RE/Golgi, avec des effets en aval sur le transport rétrograde du récepteur du mannose 6-phosphate (M6PR).
L'épuisement de l'ORP10 empêche l'échange de lipides au niveau des sites de contact RE/endosome, entraînant une perte de transport rétrograde de M6PR. De plus, les MCS RE-Golgi sont diminués et la sécrétion d'apoB-100 est augmentée.
b. ORP10 fonctionne dans l'échange de lipides entre le RE et les endosomes, transportant le PI(4)P endosomal vers le RE en échange de la phosphatidylsérine (PS) dérivé du RE.
L'enrichissement en PS au niveau de l'endosome de recyclage conduit au recrutement de l'ATPase EHD1 pour faciliter la fission de l'endosome pour le transport rétrograde.
Retour aux LTP
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesGlycérophospholipidesSphingophospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


