Protéines
Superfamille des globines
Hémoglobine : structure et liaison à l'oxygène (O2)
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'hémoglobine, comme la myoglobine, fait partie de la superfamille des globines contenant des hèmes, et est impliquée dans la liaison et/ou le transport de l’oxygène (O2), mais aussi d'autres gaz (CO2, NO, CO).
Structure des hémoglobines
Structure de l'hémoglobine (HbA)
1. L'hémoglobine A (HbA) humaine, qui représente environ 95 % des molécules d'Hb chez l'adulte, est une protéine tétramérique (α2β2) constituée de deux dimères α1–β1 et α2–β2 tête-bêche (Hemoglobin: Structure, Function and Allostery 2020).
- deux chaînes α de 141 résidus,
- deux chaînes β de 146 résidus (α2β2).
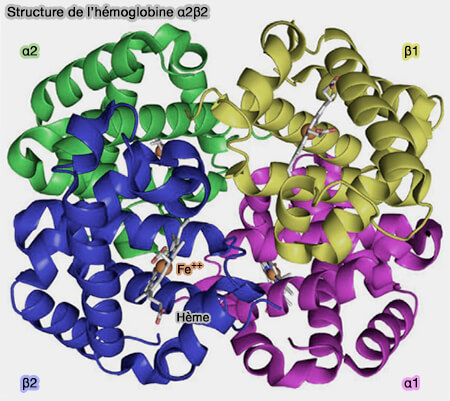
Figure : vetopsy.fr d'après Wu et coll)
a. Chaque chaîne est constituée de plusieurs hélices α (A à H), séparées par des boucles.
b. Chacune des quatre chaînes est associée à un hème b comportant un atome de fer (Fe++), de configuration planaire (
Les propriétés de résonance de la double liaison conjuguée dans l'hème, i.e. quatre groupes pyrroliques et l'atome de fer au centre, déterminent sa capacité à absorber la lumière visible et ainsi à jouer son rôle de pigment (
c. Un canal d’environ 20 Å est situé au centre de la molécule entre les deux chaînes.
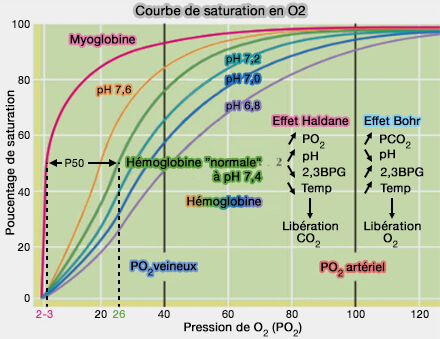
- Dans l'état T, faible affinité à l'O2, cette cavité est plus large et est occupée le plus souvent par le 2,3-bisphosphoglycérate (2,3-BPG) dans les globules rouges.
- Dans l'état R, forte affinité à l'O2, elle est plus étroite et libre.
2. L'atome de fer peut établir 6 liaisons de coordination.
a. Quatre liaisons sont établies avec les atomes d’azote de la porphyrine.
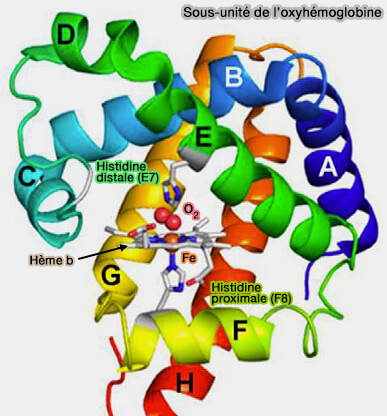
Figure : vetopsy.fr d'après Wu et coll)
b. Une liaison libre, au-dessus du plan, permet la liaison à une molécule d’O2 pour former l'oxyhémoglobine.
$\ce{Hb (hème b Fe++) + O2}$ $\leftrightharpoons$ $\ce{oxyHb (hème b Fe++-O2) }$
c. Une liaison avec une histidine dite proximale dans la chaîne F, i.e. F8, au-dessous du plan, joue un rôle clé pour l’alignement de l’hème dans la protéine et pour la fixation efficace de l’O2 (Roles of Fe-Histidine bonds in stability of hemoglobin: Recognition of protein flexibility by Q Sepharose 2021).
- Le groupe imidazole de la chaîne latérale contient un atome d’azote capable de faire une liaison de coordination, dite aussi dative, avec le Fe++.
- La fixation de l’O2 de l’autre côté du plan provoque un changement de conformation de la sous-unité qui produit un mouvement transmis à toute l’hémoglobine pour favoriser la fixation d’oxygène sur les autres sous-unités.
3. Une autre histidine (E7), dite distale, est située au-dessus du site de fixation de l’O2. i.e.du côté opposé à l’histidine F8, et crée un encombrement stérique.
a. L’histidine E7 ne se lie pas directement au fer, mais forme une liaison hydrogène avec l’oxygène pour stabiliser sa fixation réversible au Fe avec un coude de 120°.
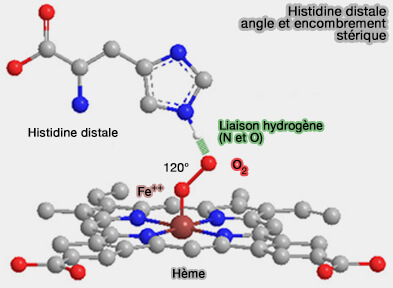
Figure : vetopsy.fr d'après Mrbean427l)
En modulant l’environnement stérique et chimique autour de l’hème, E7 favorise la réversibilité de la liaison et participe ainsi à la libération de l’oxygène dans les tissus, là où la pression partielle d’O2 est faible.
b. En outre, E7 protège l'hème de la liaison avec le monoxyde de carbone (
4. L'Hb peut contenir un ion ferrique Fe+++, i.e. méthémoglobine (MetHb) de couleur brun foncé, qui ne peut transporter l'O2, et qui est retrouvée en très petite quantité, de 1 à 2 % (Méthémoglobinémie 2024).
a. La cytochrome b5 réductase (EC 1.6.2.2), ou méthémogmlobuline réductase, enzyme à NADH, ayant FAD comme coenzyme, permet la reconversion en ion Fe++, comme le fait l'ubiquinol (QH2) dans le complexe III de la chaîne respiratoire.
$\ce{ 2 ferricytochrome b5 (Fe+++) + NaDH + H+}$ $\leftrightharpoons$ $\ce{2 ferrocytochrome b5 (Fe++) + NaD}$
b. Elle provoque des méthémoglobinémies si le taux de méthémoglobine est trop élévé dans le sang.
Remarque : le cyanure (CN⁻) peut se fixer sur l'ion ferrique Fe+++ de la MetHb pour former la cyanométhémoglobine, complexe très stable et coloré, ce qui le rend utile en spectrophotométrie, en particulier pour le dosage de l'hémoglobine totale en laboratoire.
- Le cyanure (CN⁻) est un toxique puissant qui bloque la chaîne respiratoire mitochondriale en se fixant sur le Fe+++ de l'hème a3 du complexe IV (cytochrome c oxydase).
- En cas d’intoxication, le bleu de méthylène ou l’administration de nitrate de sodium peuvent être utilisés pour oxyder l’Hb en MetHb qui fixera le cyanure pour former la cyanométhémoglobine et ainsi protéger la mitochondrie.
Autres hémoglobines
1. Chez l'homme, on trouve deux autres hémoglobines :
- l'hémoglobine A2 (HbA2) de formule α2δ2,
- l'hémoglobine F (HbF, fœtale) de formule α2γ2, prédominante chez le fœtus et le nouveau-né où elle représente 60-90 % à la naissance, puis diminue rapidement ensuite.
2. Par contre, dans les hémoglobinopathies, mutations génétiques affectant la structure des chaînes de globine, on trouve (Normal and Abnormal Hemoglobins 2019) :
- l'hémoglobine S (HbS) à mutation de la chaîne bêta, responsable de la drépanocytose (anémie falciforme),
- d'autres mutations, HbC, D, E, G, Lepore…
3. Les thalassémies sont des maladies avec des défauts de synthèse des chaînes globines normales par ailleurs qui entraînent un déséquilibre dans la composition des hémoglobines et une anémie :
- alpha-thalassémie, défaut de production des chaînes alpha,
- bêta-thalassémie, défaut de production des chaînes bêta.
Mécanisme de fixation de l'oxygène (O2)
La désoxyhémoglobine, hémoglobine sans O2, va former de l'oxyhémoglobine (HbO2).
1. L’O2 se lie à l’atome de Fe++ dans l’hème b selon un angle de 120°.
(Figure : vetopsy.fr)
Cette liaison est réversible, ce qui permet à l’hémoglobine de capter l’oxygène dans les poumons et de le libérer dans les tissus.
2. Fe++ passe d'un état pentracoordonné, i.e. désohyhémoglobine, à un état hexacoordonné, i.e. oxyhémoglobine.

Vous pouvez lire : Heme–Protein Interactions and Functional Relevant Heme Deformations: The Cytochrome c Case (2022).
a. Un champ ligand décrit la force du champ électrostatique créé par les ligands autour du Fe++ qui va influencer l'énergie de ces orbitales d qui sont scindées en deux groupes avec une différence d'énergie Δ0, appelée énergie de clivage du champ ligand :
- t2g, plus basses en énergie, orientées entre les axes x, y, z, donc moins exposées aux ligands, i.e. $\ce{d_{xy}}$, $\ce{d_{xz}}$ et $\ce{d_{yz}}$,
- e-g , plus hautes en énergie, qui pointent directement vers le ligand, i.e. $\ce{d_{x^2 - y^2}}$ et $\ce{d_{z^2}}$.
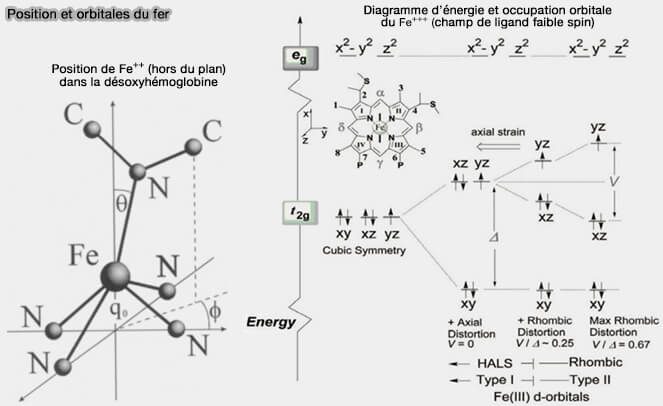
(Figure : vetopsy.fr d'après Schweitzer-Stenner)
b. Dans la désoxyhémoglobine, le champ ligand est faible, Δ0 est petit et le spin est haut, i.e. état où le nombre d’électrons non appariés est maximal, ici 4 déparés ou célibataires, nombre quantique de spin, $\ce{$s = 2$}$.
- Les électrons occupent alors les orbitales hautes, i.e. périphériques, car il est moins coûteux de placer les électrons dans les orbitales e-g, même si elles sont plus hautes en énergie, plutôt que de les apparier (
règle de Hund).
- Le volume de Fe++ augmente et rend la configuration de l'hème légèrement pyramidale.
- Cette conformation tire Fe++ le place à environ 0,4 Å au-dessus du plan de la molécule d’hème, i.e. on le dit parfois " hors du plan " ce qui déforme légèrement l’hème.
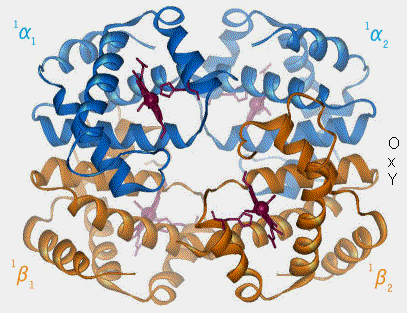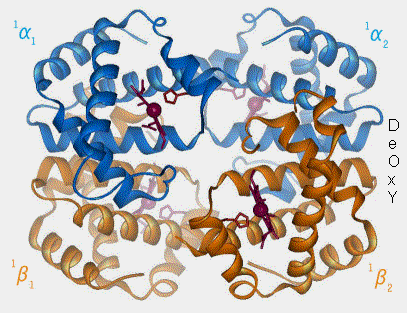
Figure : vetopsy.fr d'après en:User:BerserkerBen)
c. Dans l'oxyhémoglobine, le champ ligand est fort, Δ0 est grand et le spin est faible, pas d'électrons célibataires, i.e. donc $\ce{$s = 0$}$.
- Les électrons occupent alors les orbitales basses, i.e. proches du noyau, car il est moins coûteux d’apparier les électrons dans les orbitales t2g que de les promouvoir dans les orbitales e-g.
- Le volume de cet atome diminue et il devient quasi coplanaire, i.e. dans le plan de l’hème.
2. Ce léger déplacement d'environ 0,4 Å déclenche un changement de conformation de toute la molécule d’hémoglobine (Hemoglobin: Conformational Changes Upon Oxygen Binding in Several Representations).
a. Comme Fe++ est lié à l'histidine proximale (F8), son mouvement provoque un déplacement de l’hélice F à laquelle elle est attachée.

Vous pouvez lire : Hemoglobin: Structure, Function and Allostery (2020) pour comprendre les différentes modifications, et Direct observation of conformational population shifts in crystalline human hemoglobin (2017).
Figure : vetopsy.fr d'après en:User:BerserkerBen)
b. Ce changement provoque une réorganisation des contacts entre les sous-unités α1β2 et α2β1, les autres interfaces α1β1 et α2β2 restent constantes (A Third Quaternary Structure of Human Hemoglobin A at 1.7-A Resolution 1992).
- Ces interfaces subissent un glissement et une rotation (~15°) qui modifie les contacts ioniques, hydrogènes et hydrophobes.
c. Ce passage de l’état T (tendu) à R (relâché) augmente l'affinité pour l'O2 (Heme proteins Cooperativity Bohr effect Collective Dynamics Underlying Allosteric Transitions in Hemoglobin 2013 et Quaternary Structure Transitions of Human Hemoglobin: An Atomic-Level View of the Functional Intermediate States 2021).
Remarque : il existe des stades intermédiaires discutés et controversés par les scientifiques

Ce changement de conformation de la sous-unité favorise la fixation d’oxygène sur les autres sous-unités par effet allostérique (effet coopératif).


