Protéines
Superfamille des globines
Vue d'ensemble
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les membres de la famille des globines sont toutes caractérisées par une structure globulaire, un groupement hème qui lie l’oxygène, et une fonction souvent liée au transport ou à la détection de gaz (O2, NO, CO...).
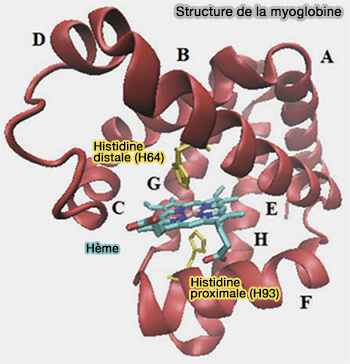
Les globines les plus connues sont l'hémoglobine et la myoglobine.
Structure globale des globines
Les globines ont en commun un repliement globine qui comprend huit hélices α.
(Figure : vetopsy.fr)
Le repliement globine fut le premier repliement protéique découvert, la myoglobine a été la première protéine dont la structure a été résolue.
1. Les huit hélices α du noyau du repliement de la globine partagent une structure non locale significative, contrairement à d’autres motifs structurels dans lesquels les acides aminés proches les uns des autres dans la séquence primaire sont également proches dans l’espace.
Les hélices s’emboîtent à un angle moyen d’environ 50 °, nettement plus grand que d’autres empilements hélicoïdaux tels que le faisceau d’hélices.
2. Les globines ont évolué à partir d’un ancêtre commun et peuvent être divisées en trois lignées (Three globin lineages belonging to two structural classes in genomes from the three kingdoms of life 2005).
- la famille F, pour flavohémoglobine ou M pour myoglobine-like,
- la famille S pour senseur-like,
- la famille T, pour tronquée.

Vous pouvez lire : Lessons from the post-genomic era: Globin diversity beyond oxygen binding and transport (2020).

(Figure : vetopsy.fr d'après Keppner et coll)
Différentes globines
Les caractéristiques des principales globines sont résumées dans un tableau.

L'hémoglobine (Hb) et la myoglobine (Mb) sont étudiées dans un chapitre spécial.
| Globine | Localisation | Rôle principal | Structure | Particularités biochimiques |
|---|---|---|---|---|
| Mammifères | ||||
| Hémoglobine (Hb) | Globules rouges (érythrocytes) | Transport de l’O2 (et CO2) entre poumons et tissus | Tétramère (α2β2) | Coopérativité, effet Bohr, régulation allostérique |
| Myoglobine (Mb) | Muscles squelettiques et cardiaques |
Stockage et libération locale d’O2 | Monomère | Affinité élevée pour O2, pas de coopérativité |
| Neuroglobine (Ngb) | Neurones, rétine, cellules gliales |
Protection contre hypoxie/ischémie, signalisation | Monomère | Liaison transitoire à l’O2, rôle neuroprotecteur |
| Cytoglobine (Cygb) | Cellules mésenchymateuses, fibroblastes | Réponse au stress oxydatif, régulation NO | Monomère | Expression augmentée sous hypoxie, fonction redox |
| Androglobine (Adgb) | Testicules (spermatogenèse) | Inconnue, potentiellement impliquée dans la maturation | Structure complexe (multi-domaines) | Très peu connue, domaine à hélice unique |
| Plantes et bactéries | ||||
| Phytoglobines | Plantes (racines, nodules, tiges) | Transport de NO, régulation de l’hypoxie | Variable | Intervient dans symbiose (légumineuses), signalisation |
| Globine VHb | Bactérie Vitreoscilla | Amélioration de la respiration bactérienne en hypoxie | Monomère | Exprimée parfois dans cellules eucaryotes en biotech |


