Glucides
Glycosylation
: N-Glycosylation
Mécanisme
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le mécanisme de la N-glycosylation est complexe et s'effectue au niveau du réticulum endoplasmique (RE) et de l'appareil de Golgi.
Le processus s'effectue en plusieurs phases.
(Figure : vetopsy.fr)
La glycosylation commence par la formation d'un dérivé d'oses formé par :
- la N-acétyl-D-glucosamine (GlcNAc) liée par la liaison pyrophosphate riche en énergie avec,
- le dolichol (DOL).

Vous pouvez lire : Chapter 4 N-Glycans (2022) de Essentials of Glycobiology [Internet]. 4th edition, chapitre dans lequel les N-glycanes et le processus de N-glycosylation sont détaillés.
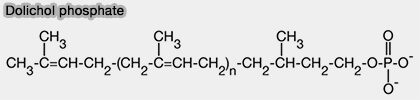
Dolichol et dolichol phosphate
1. Le dolichol est un lipide polyisoprénique, i.e. constitué d'un nombre variable de groupes isoprène, i.e. de formule $\ce{(-CH=C(CH3)−CH=CH-)_n}$ ou $\ce{(-C5H6-)_n}$, terminé par un groupe isoprène α-saturé portant un groupe alcool ($\ce{-OH}$).

Vous pouvez lire : From glycosylation disorders to dolichol biosynthesis defects: a new class of metabolic diseases (2011).
2. Sa synthèse de novo est commune avec celle des stérols, des isoprènes et des terpènes, par la voie des mévalonates, et se déroule du côté cytoplasmique du réticulum endoplasmique (RE).
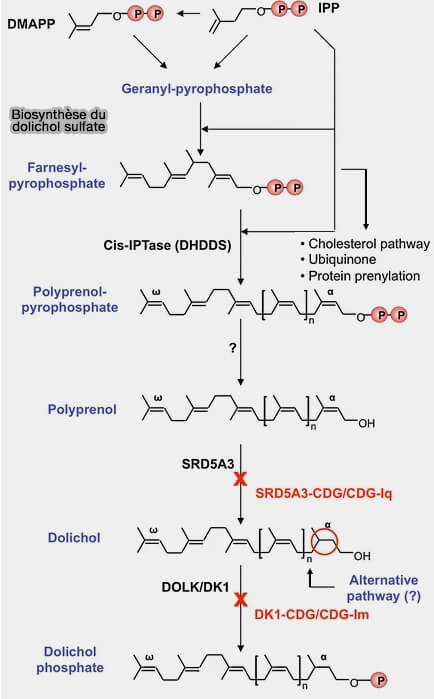
(Figure : vetopsy.fr d'après Cantagrel et Lefeber)
a. L'IPP (isopentenyl pyrophosphate) se condense avec le DMAPP (dimethylallyl pyrophosphate) pour former les blocs de 5 carbones de tous les isoprénoïdes, en passant par le géranyl-pyrophosphate qui se condense encore avec IPP pour former le farnésyl-pyrophosphate, produit final de la voie des mélavonates (
b. Le farnésyl pyrophosphate est allongé par la déhydrodolichyl diphosphate synthase ou DHDDS (EC 2.5.1.87), cis-prényl transférase qui utilise l'IPP comme substrat pour produire du pyrophosphate de polyprénol (FPP), i.e. ($\ce{(-CH5H8-)_n-O-P-P}$).
Cette réaction s'effectue par addition cis-séquentielle tête-bêche de plusieurs molécules d'IPP au pyrophosphate de farnésyle (FPP).
c. Le pyrophosphate de polyprénol est probablement déphosphorylé en polyprénol, avant sa réduction, mais rien n'est moins sûr.
- En effet, une déphosphorylation pourrait transformer le DOL-PP en DOL-P dans le RE et pourrait alors jouer un rôle de réserve de DOL-P pour les glycosylations.
- Toutefois, une molécule d'isopentol pourrait se rajouter au polyprénol-pyrophosphate, évitant ainsi la déphosphorylation et la réduction.
d. Le polyprénol est réduit en dolichol par la 3-oxo-5alpha-stéroïded 4-déhydrogénase ou SRD5A5 (EC 1.3.1.22) qui sature le groupe isoprénoïde α, i.e. lui enlève sa double liaison.
e. Enfin, DOLK, la dolichol kinase (EC 3.1.3.51), transfère un phosphate de la cytidine-triphosphate (CTP) vers le dolichol pour engendrer du DOL-P à l'origine de la première phase de la N-glycosylation.
1. Phase 1 sur et dans le RE :
synthèse de l'oligosaccharide précurseur lié au dolichol
Le mécanisme de la première phase implique la synthèse préliminaire d'un oligosaccharide de base relié au dolichol par une liaison pyrophosphate, i.e. un phosphate est originaire du dolichol-P, l'autre du nucléotide-ose.
Étape 1 de la première phase
Le dolichol phosphate (DOL-P), à la surface cytoplasmique du réticulum endoplasmique (RE), est un accepteur de la N-acétyl-D-glucosamine (GlcNAc).
1. Deux résidus de N-acétylglucosamines sont transférés à partir de l'UDP-N-acétylglucosamine (UDP-GlcNAc), conduisant à un dolichol pyrophosphate N,N' diacétylchitobiose ($\ce{DOL-P-P-(GLcNAc)_2}$).
a. $\ce{DOL-P + UDP-N-acétylglucosamine (Glc-NAc)}$ $\longrightarrow$ $\ce{DOL-P-P-GLcNAc}$ par la DPAGT1 (UDP-N-acétylglucosamine-dolichyl-phosphate N-acétylglucosaminephosphotransférase).
b. $\ce{DOL-P-P-GLcNAc + UDP-Glc-NAc}$ $\longrightarrow$ $\ce{DOL-P-P-(GLcNAc)_2}$ par ALG13/14, i.e. les ALG sont les Asparagine-Linked Glycosylation protein qui sont aussi des glycosyltransférases (EC 2.4.).
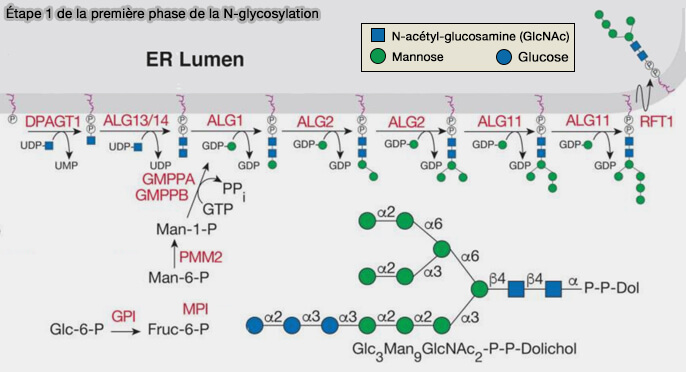
(Figure : vetopsy.fr d'après Stanley et coll)
2. Sur ce composé viennent se greffer 5 unités de mannose à partir de GDP-mannose par ALG1, ALG2 et ALG11.
$\ce{DOL-P-P-(GLcNAc)_2 +5GDP-mannose}$ $\longrightarrow$ $\ce{DOL-P-P-(GLcNAc)_2-(Man)_5}$
Étape 2 de la première phase

Cet intermédiaire est ensuite réorienté vers la face luminale du RE (par une flippase ?).
1. Quatre molécules de mannose, à partir de GDP-mannose, sur une branche, puis trois résidus de glucose sur l'autre branche à partir de l'UDP-glucose, sont rajoutés dans la lumière au DOL-P-P.
a. $\ce{4(DOL-P + GDP-mannose)}$ $\longrightarrow$ $\ce{4(DOL-P-mannose +GDP)}$ par ALG3, ALG9, ALG12.
b. $\ce{3(DOL-P + UDP-glucose)}$ $\longrightarrow$ $\ce{3(DOL-P-glucose +UDP)}$ par ALG6, ALG8 et ALG10.
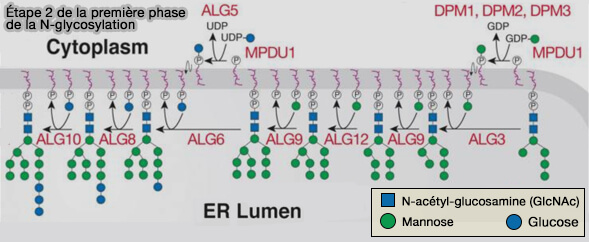
(Figure : vetopsy.fr d'après Stanley et coll)
2. Ces sept oses sont rajoutés au premier oligosaccharide.
$\ce{DOL-P-P-(GLcNAc)_2-(Man)_5 + 4Man + 3 Glu}$ $\longrightarrow$ $\ce{DOL-P-P-(GLcNAc)_2-(Man)_9-(Glu)_3}$
2. Phase 2 dans le RE :
transfert en bloc de l'oligosaccharide précurseur à la protéine
1. L'oligosaccharide complet formé dans cette première phase de la N-glycosylation est alors transféré du dolichol sur un polypeptide en cours de synthèse, qui émerge de la membrane dans la lumière du réticulum endoplasmique (RE) pour former le N-glycane.
La N-glycosylation est donc co-traductionnelle, i.e. elle se déroule en même temps que la synthèse de la protéine, ce qui n'est pas le cas de la O-glycosylation qui est post-traductionnelle, i.e. elle se déroule après la synthèse de la protéine.
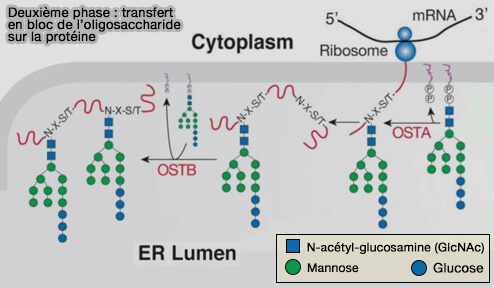
(Figure : vetopsy.fr d'après Stanley et coll)
2. La réaction consiste en l'hydrolyse de la liaison pyrophosphate par l'oligosaccharyltransferase ou OST (EC 2.4.1.119) qui apporte l'énergie nécessaire pour le remplacement du DO-PP par le peptide via son asparagine (Asn ou N).
$\ce{DOL-P-P-(GLcNAc)_2-(Man)_9-(Glu)_3 + protéine-L-asparaginyl}$ $\leftrightharpoons$ $\ce{DOL-P-P + protéine-L-asparagynyl-(GLcNAc)_2-(Man)_9-(Glu)_3}$
L'asparagine doit être localisée dans un motif Asn-X-sérine ou Asn-X-thréonine, ou dans de rares cas Asn-X-cystéine, X étant un acide aminé quelconque, excepté la proline et l'aspartate.
- Elle doit être située à la surface de la protéine.
- Elle doit être trouvée sur le côté luminal du réticulum endoplasmique pour que la glycosylation N-liée soit initiée sur des protéines sécrétoires ou des protéines transmembranaires qui font face à la lumière.
3. Phase 3 dans le RE : perte des glucoses et pliage de la protéine
Le N-glycane, i.e. $\ce{protéine-L-asparagynyl-(GLcNAc)_2-(Man)_9-(Glu)_3}$ est alors modifié.
1. Dans le réticulum endoplasmique (RE), le N-glycane perd ces trois glucoses.
a. Les deux premiers glucoses sont éliminés par les glycosides hydrolases ou glycosidases (EC 3.2.1.x) en particulier les exoglycosidases fonctionnant sur les liaisons glycosidiques des extrémités (Exo- and endoglycosidases revisited 2013).
Ces exoglycosidases, peu spécifiques, catalysent la réaction pratiquement irréversible car exergonique, $\ce{Gly}$ étant un résidu osyle, $\ce{R}$ étant un résidu osyle, aglycone, oligo ou polysaccharide :
$\ce{Gly-O-R}$ $\longrightarrow$ $\ce{Gly-OH = HO-R}$
$\ce{protéine-L-asparagynyl-(GLcNAc)_2-(Man)_9-(Glu)_3}$ $\longrightarrow$ $\ce{protéine-L-asparagynyl-(GLcNAc)_2-(Man)_9-(Glu}$
b. Le dernier glucose est éliminé par l'alpha-mannosidase du RE (EC 3.2.1.24).
$\ce{protéine-L-asparagynyl-(GLcNAc)_2-(Man)_9-Glu}$ $\longrightarrow$ $\ce{protéine-L-asparagynyl-(GLcNAc)_2-(Man)_9}$
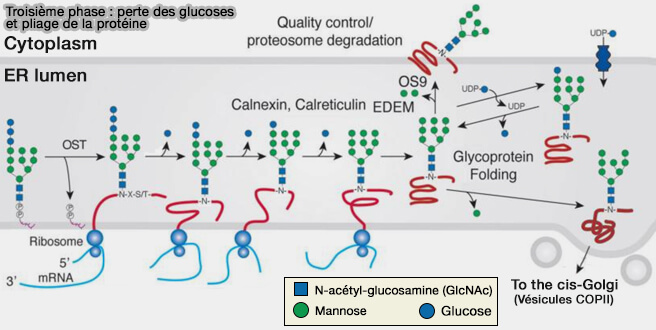
(Figure : vetopsy.fr d'après Stanley et coll)
2. Le pliage correct de la protéine est essentiel pour que cette dernière réaction soit possible, i.e. elle doit subir un contrôle qualité, sinon elle reste dans le RE et se voit retirer sa chaîne glucidique par une N-glycanase et ajouter un signal de dégradation par une mannosidase pour l'envoyer vers le protéasome.
a. Ce contrôle de qualité s'effectue dans le RE rugueux par l'intermédiaire de :
- lectines chaperonnes telles que la calnexine ou la calréticuline,
- protéines chaperonnes spécifiques du RE appelées BIP de la famille des protéines de choc thermique.
b. Elles sont accompagnées de glycosylases qui vont amputer la chaîne oligosaccharidique pour permettre le processus de vérification de bonne conformation de la protéine, qui, si elle est bien conformée, va poursuivre sa N-glycosylation dans l'appareil de Golgi.
4. Phase 4 dans l'appareil de Golgi : modifications du N-glycane
Ce N-glycane, i.e. sans glucose du RE, est alors transféré du réticulum endoplasmique (RE) vers l'appareil de Golgi par des vésicules COPII, où il peut subir des transformations au fur à mesure de son passage cis-Golgi ➞ trans-Golgi (TGN).
1. Dans le cis-Golgi, des réactions :
- éliminent des glucides par les glycosidases, i.e. en particulier 3 mannoses par les mannosidases (MAN1A1, MAN1A2, MAN1C1) dans le cis-Golgi jusqu’à la formation de Man5GlcNAc2,
- peuvent rajouter des GlcNac par phosphorylation des mannoses.
2. Dans le Golgi médial et le trans-Golgi, ces réactions peuvent ajouter des glucides pour obtenir les trois types de N-glycanes.
- par les glycosyltransférases, en particulier des GlcNAc transférases, dans le Golgi médian,
- par les galactosyltransférases et les sialyltransférases dans le trans-Golgi (TGN).
Les modifications sont complexes et très variables et vous pouvez les suivre dans cette figure tirée de N-Glycans.


