Cofacteurs
cofacteurs d'oxydoréduction
Hèmes et cytochromes: rôles
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le rôle des hèmes est de lier, transformer ou détecter des molécules clés (O2, NO, CO, électrons, radicaux…), en jouant un rôle essentiel dans la respiration, la signalisation, la défense oxydative et la régulation génique.
Rôles des hèmes
Les rôles des hèmes sont multiples.
Transport et stockage d’oxygène
Le Fe++ de l'hème b fixe de manière réversible l'oxygène O2 pour (Les protéines fixatrices de dioxygènes : myoglobine et hémoglobine) :
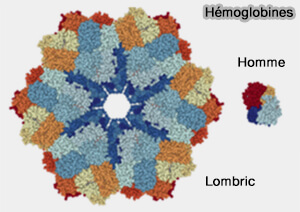
(Figure : vetopsy.fr
d'après thebloodproject.com)
1. le transporter :
- dans le sang des vertébrés par l'hémoglobine (Hb) contenue dans les érythrocytes,
- dans les tissus de certains invertébrés, comme dans le plasma du lombric qui possède une hémoglobine extracellulaire géante de poids > 3 500 kDa, ou dans le liquide coelomique de certains mollusques,
2. le stocker dans le muscle par la myoglobine (Mb).
$\ce{Hb (hème b Fe++) + O2}$ $\leftrightharpoons$ $\ce{oxyHb (hème b Fe++-O2) }$

L'hème b de l'hémoglobine est étudié dans le mécanisme de fixation de l'oxygène (O2) dans l'hémoglobine.
Transport d'électrons
Les cytochromes b, c, a, a₃ jouent un rôle essentiel dans le transfert d’électrons dans la chaîne respiratoire mitochondriale ou la photosynthèse.

Dans cette fonction, le fer hémique passe d'un état ferreux Fe++ (oxydé) à un état ferrique Fe+++ ( réduit), et inversement, sans perdre l’intégrité de la porphyrine.
1. Dans la chaîne respiratoire mitochondriale, les complexes sont les suivants.
a. Le complexe II, i.e. succinate déshydrogénase (SDH) ou succinate-coenzyme Q réductase (SQR), contient un hème b, dont le rôle est obscur, mais qui ne ferait que stabiliser le complexe ou servir d'intermédiaire dans le transfert d'électrons (
b. Le complexe III ou coenzyme Q-cytochrome c réductase contient (
- le cytochrome b à deux hèmes b à spins différents, bL et bH pour conduire un électron au site Qi,
- le cytochrome c1 à hème c pour transmettre l'autre électron au cytochrome c dans l'espace intermembranaire mitochondrial (IMS), qui le transfère du complexe III au complexe IV.
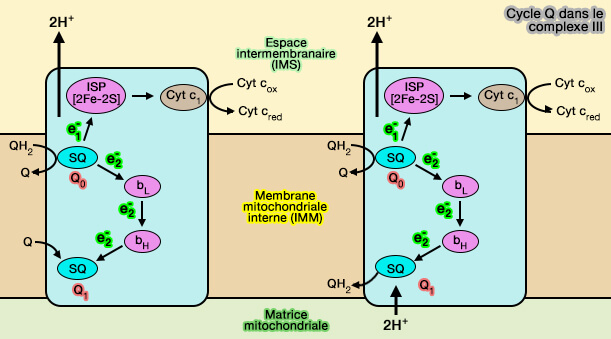
(Figure : vetopsy.fr)
c. Le complexe IV ou cytochrome c oxydase contient l'hème a à faible spin, et l'hème a3 à fort spin couplé à CuB, qui constitue le site actif de l’enzyme (
2. Dans la photosynthèse, les complexes sont les suivants.
a. Dans le complexe cytochrome b6f (plastoquinol-plastocyanine réductase), on trouve :
- le cytochrome b6 à deux hèmes b à spins différents, bL et bH ,comme pour le complexe III, pour conduire un électron au site Qi,
- le cytochrome f, variante du cytochrome c, pour transmettre l'autre électron pour le transmettre à la plastocyanine.
b. PSII contient également un petit cytochrome b559 qui ne participe pas directement au transfert d’électrons.
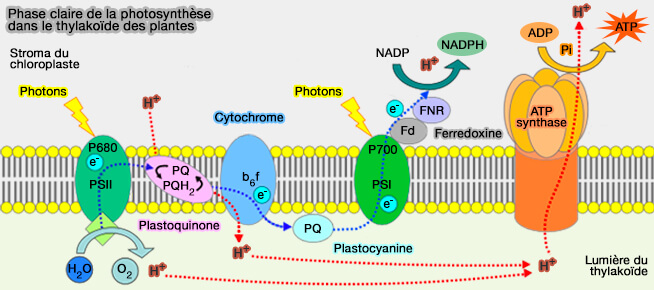
(Figure : vetopsy.fr d'après Somepics)
Catalyse enzymatique
Les hèmes activent de petites molécules, i.e. O2, NO, CO, H2O2… souvent très stables ou peu réactives, pour permettre des réactions enzymatiques spécifiques.

Vous pouvez lire : Heme Enzyme Structure and Function (2015) qui détaille de nombreux enzymes
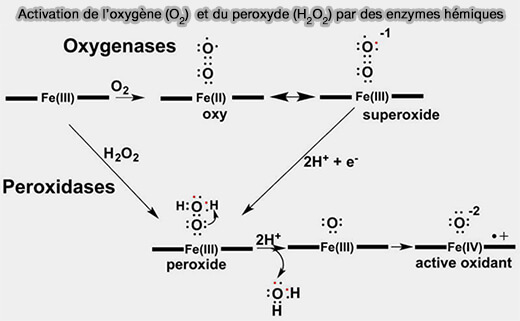
(Figure : vetopsy.fr d'après Poulos)
Le tableau ci-dessous donne quelques exemples.
| Enzyme / Protéine à hème | Petite molécule activée ou liée | Type de catalyse | Rôle principal |
|---|---|---|---|
| Cytochromes (b, c, a, f) | Électrons (pas de molécule liée directement) | Transfert d'électrons (oxydoréduction) |
|
| Catalases | H2O2 (formaldéhyde) |
Décomposition en H2 et O2 |
Protection cellulaire contre le stress oxydatif |
| Peroxydases | H2O2 | Oxydation de substrats à partir de H2O2 | Défense contre les peroxydes, métabolisme |
| Cytochromes P450 | O2 | Hydroxylation (insertion d'oxygène) |
Métabolisme des composés organiques, détoxification |
| Myoglobine / Hémoglobine | O2, CO, NO | Transport et liaison réversible | Stockage et transport d'oxygène, signalisation |
| Guanylate cyclase soluble (cGMP) | NO | Activation enzymatique via liaison | Signalisation cellulaire (messager secondaire) |
Capteurs et régulateurs
Les hèmes sont utilisés ici, non pas pour transformer chimiquement les gaz comme O2, NO ou CO, mais pour détecter leur présence et moduler une activité biologique enzymatique ou transcriptionnelle.
C’est une forme de signalisation moléculaire.
| Protéine | Gaz détecté | Rôle du hème | Fonction régulée | Type de réponse |
|---|---|---|---|---|
| Guanylate cyclase soluble (cGMP) | NO | Liaison directe de NO sur Fe++ du hème ➞ rupture de liaison His |
Active la production de GMPc à partir de GTP | Signalisation (vasodilatation, neurotransmission) |
| NPAS2 | O2, CO | Hème lié au facteur de transcription ➞ sensible aux ligands |
Régule les gènes de l'horloge circadienne | Contrôle transcriptionnel |
| REV-ERBα/β | CO, NO | Facteurs de transcription nucléaires à hème | Régulation de gènes du rythme circadien et métabolisme | Répression/activation transcriptionnelle dépendante du ligand |
| PGRMC1 (progesterone receptor membrane component 1) | CO ? (possiblement) | Hème lié, rôle mal défini encore | Signalisation cellulaire, transport du stéroïde, possible rôle dans la régulation | ? |
| CBS (cystathionine β-synthase) | CO, NO | Hème régule l'activité enzymatique selon les ligands | Métabolisme du soufre et régulation de la production de H2S | Inhibition ou activation enzymatique selon le gaz |
| HO-2 (hème oxygénase 2) | O2, CO | Hème à la fois substrat et capteur ➞ activité influencée par O2 |
Catalyse la dégradation du hème ➞ production de CO |
Réponse à l'hypoxie/signalisation |
Retour aux cofacteurs d'oxydoréduction
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesGlucidesLipidesEnzymesCofacteursCofacteurs d'oxydoréductionCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


