Bioénergétique : composés " riches en énergie "
Composés à liaison phosphate
ATP : phosphorylation oxydative
ATP synthase : mécanisme de de FO
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le mécanisme de la région FO de l'ATP synthase, encore mal compris, est associé à des rotations de l’anneau c et à la sous-unité a/ATP6 qui jouent tous deux un rôle dans la translocation complexe des protons à travers la membrane mitochondriale interne (IMM).
(Vidéo : Harward Online)

Les mécanismes exacts ne sont toujours pas bien compris à l'heure actuelle.
Mécanisme de FO
Vue d'ensemble
Les rôles de la sous-unité a/ATP6 et de l’anneau c8 dans la translocation des protons à travers la membrane mitochondriale interne (IMM) sont complexes.
La rotation est la conséquence du passage des protons du compartiment intermembranaire à la matrice via le canal à protons de l’enzyme.
1. L'anneau c8 se compose de huit sous-unités c formant un cercle, et chaque sous-unité adopte une forme en épingle à cheveux.
- La translocation des protons est due à une correspondance de forme étroite entre l'anneau c8 et l'épingle à cheveux hélicoïdale concave α5-α6 de la sous-unité a/ATP6.
- Cette orientation limitée de l'anneau c8 par rapport à la sous-unité a/ATP6 montre que de fortes interactions entre elles sont maintenues à travers des hélices α hautement inclinées de la sous-unité a, mais n'affecte pas la rotation pendant la synthèse de l'ATP.
2. La translocation des protons des mammifères implique deux demi-canaux, i.e. d'entrée et de sortie, qui sont retrouvés dans les enzymes :
- des bactéries (Structure of a bacterial ATP synthase 2019),
- des levures (High-resolution cryo-EM analysis of the yeast ATP synthase in a lipid membrane 2018 et Atomic model for the dimeric FO region of mitochondrial ATP synthase 2017).
- des chloroplastes (Structure, mechanism, and regulation of the chloroplast ATP synthase 2018).

Vous pouvez lire : Structure of the dimeric ATP synthase from bovine mitochondria (2020), article duquel est tiré l'essentiel de ce chapitre.
Translocation des protons : mécanisme de Grotthuss
Le mécanisme de Grotthuss est un mécanisme par lequel un proton en " excès " se transmet à travers les liaisons hydrogène des molécules d'eau ou d'autres liquides comportant des liaisons hydrogène, par la formation ou la rupture de liaisons covalentes.

Vous pouvez lire : Search for a Grotthuss mechanism through the observation of proton transfer (2023) qui explicite la figure ci-dessous, figure simplifiée dans Searching for the Grotthuss mechanism (2023).
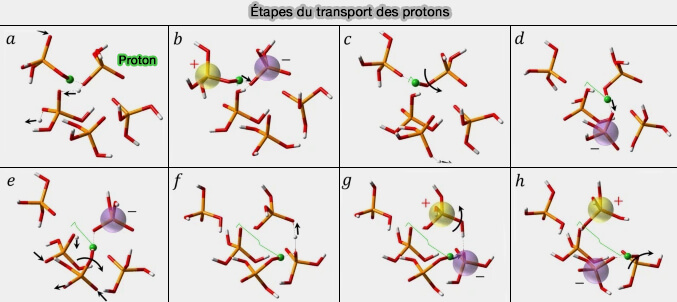
(Figure : vetopsy.fr d'après Popov et coll)
La sous-unité a forme 2 demi-canaux à protons permettant le passage des protons entre les deux faces de la membrane mitochondriale interne (IMM) à l’intérieur de la bicouche, i.e. le passage d’un demi-canal à l’autre s’effectuant via les sous-unités c.
1. Dans l'ATPase humaine, deux patchs chargés négativement et conservés chez les mammifères régulent la translocation de protons entre les demi-canaux et le transporteur de protons conservé Glu58 de la sous-unité c qui est exposé au milieu de l'hélice transmembranaire extérieure de l'anneau.
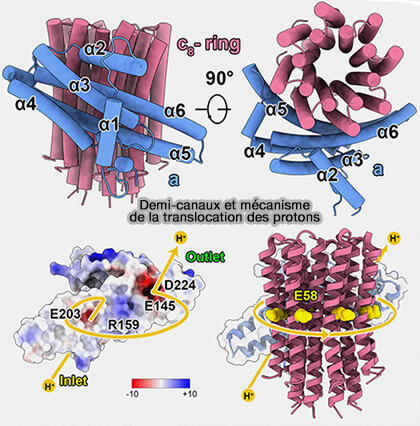
(Figure : vetopsy.fr d'après Lai et coll)
a. Ces patchs correspondent :
- pour l'entrée à un patch autour de aGlu203 de la sous-unité a (E203),
- pour la sortie à un patch autour de aGlu145 (E145) et aAsp-224 (D224).
b. Ces deux demi-canaux sont séparés par aArg159 (R159).
2. Pendant la synthèse de l'ATP (
a. cGlu58 :
- obtient un proton (H+) du demi-canal de l'espace intermembranaire mitochondrial via aGlu203,
- tourne l'anneau c dans le sens antihoraire.
b. La rotation de l'anneau c apporte un cGlu58 neutre d'une sous-unité c différente dans le demi-canal de sortie vers la matrice et libère le proton avant qu'il rencontre le point de contrôle du résidu chargé positivement conservé, aArg159.
Demi-canal d'entrée
Lors de la synthèse de l’ATP, un demi-canal d’entrée passant par les hélices α H5 et H6 dans la sous-unité a (aH5 et aH6) inclinée à 30° par rapport au plan de la membrane permet aux protons (H+) d’entrer, pour se diriger vers le résidu cGlu58 (E58) chargé négativement de la sous-unités c, situé au milieu approximatif de la membrane.
Le demi-canal d’entrée, dont l'embouchure est chargée négativement, attire les ions les ions H+ (
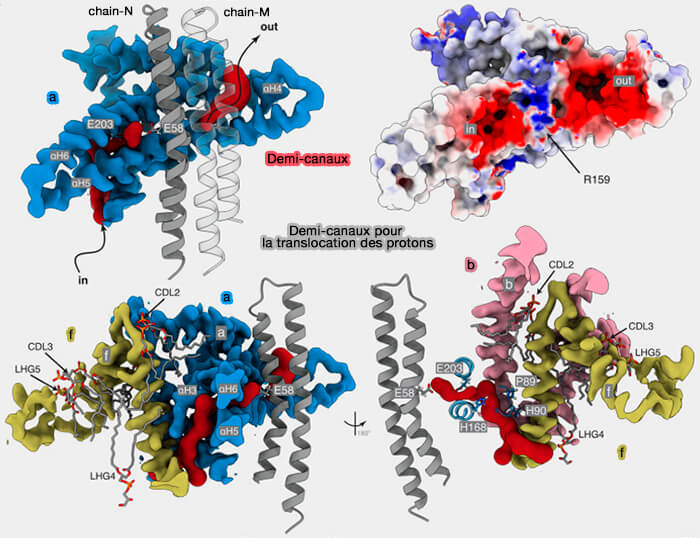
(Figure : vetopsy.fr d'après Spikes et coll)
1. Le demi-canal est formé par plusieurs éléments.
a. Les éléments des sous-unités a, b et f entrent dans cette formation.
- Le plafond est formé par la boucle entre aH3 et aH4, contenant les résidus Pro89 (P89) et His90 (H90) et avec la région C-terminale et l'hélice α transmembranaire de H3 de la sous-unité f.
- Le début est constitué par des régions de aH5 et de aH6, qui contiennent le résidu Glu203 (E203) conservé. La deuxième hélice α transmembranaire de la sous-unité b, bH3, ferme ce côté du canal, le séparant de l’environnement aqueux et de la membrane environnante.
b. Des lipides contribuent également à la formation de ce demi-canal de manière significative pour empêcher la fuite de protons par l’arrière de la sous-unité a/ATP6 par CDL2, CDL3 et LHG4 et l'effondrement du demi-canal par CDL3 et LHG4, en renforçant les relations entre les hélices α.
2. Le trajet des protons à partir de l’espace intermembranaire des mitochondries conduit à E203 de aH6 hautement conservé, situé là où le canal de solvant traverse les hélices α inclinées aH5-aH6 et de là vers le rotor c8, i.e. cGlu58 (E58).
Plusieurs résidus polaires et chargés dans le demi-canal d’entrée se lient par des liaisons hydrogène à un réseau de cinq molécules d’eau, W1 à W5, pour transférer des protons par un mécanisme de Grotthuss.
- Les distances relativement grandes entre W5 et aGlu203, et entre aGlu203 et cGlu58, dans les dernières étapes du transfert de protons, peuvent suggérer l’implication d’autres molécules d’eau encore indéfinies.
- Alternativement, le transfert après W5 pourrait être médié par la diffusion d’ions H+ libres grâce à la proximité d’aHis-168.
3. Les protons sont transportés à travers la bicouche lipidique sur le γ-carboxyle neutralisé de E58 par la rotation du cycle c8 vers le demi-canal de sortie où ils sont libérés par l’Arg159 (R159) chargée positivement, fournie par les hélices α inclinées dans la sous-unité a/ATP6.
Les demi-canaux sont séparés par la région chargée positivement fournie par aR159 hautement conservée, entre autres, qui empêche, probablement par répulsion de charge, la fuite de protons de l’entrée à la sortie et favorise la déprotonation du E58 dans le canal de sortie pour entraîner la rotation de l’anneau c8 dans le sens de la synthèse.
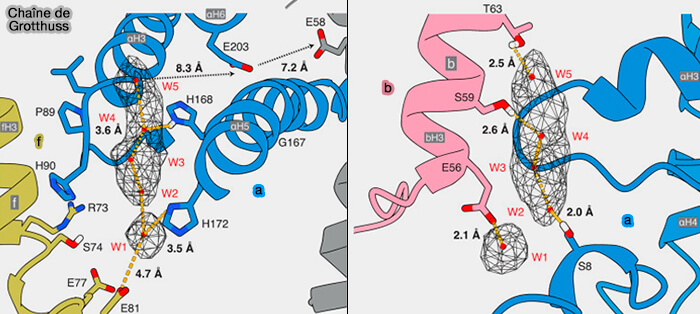
(Figure : vetopsy.fr d'après Spikes et coll)
4. En plus d’offrir une voie claire pour le transfert des protons vers l’anneau c8, la chaîne de Grotthuss présente un mécanisme apparent pour transmettre le plein potentiel énergétique de la force motrice des protons (PMF ou Δp) pour entraîner le rotor et transposer le potentiel de membrane vertical en un potentiel horizontal.
- Le fort champ électrique positif à l’entrée du canal d’entrée est conduit vers le carboxyle chargé négativement du Glu58 au milieu de la membrane et pousse l’anneau c8 vers l’avant dans la direction appropriée avec toute la force, mais perpendiculairement au gradient de protons électrochimiques.
- Alors qu’un mécanisme à cliquet brownien théorique assure la directionnalité de la rotation de l’anneau c8, le couplage direct de l’anneau au potentiel de membrane via la chaîne d’eau de Grotthuss est un mécanisme de transfert complet de la force motrice des protons à l’anneau, générant le couple nécessaire pour faire tourner l’anneau et l’ensemble du rotor contre les forces de résistance du domaine catalytique (Transient accumulation of elastic energy in proton translocating ATP synthase 1999).
Demi-canal de sortie
Le canal de sortie est formé par une grande cavité hydrophile entre l'anneau c et l'extrémité en épingle à cheveux des hélices α5-α6 de la sous-unité a/ATP6.
Dans le demi-canal de sortie en forme d’entonnoir plus ouvert, une forte densité près de l’aR159, avec la fraction hydroxyle de l’aTyr221 pointant vers elle, pourrait être une molécule d’eau spécifiquement liée, qui accepterait le proton sortant de cGlu58, probablement via de l’eau diffusant librement, car la distance entre cGlu58 et aArg159 est trop grande pour un transfert direct.
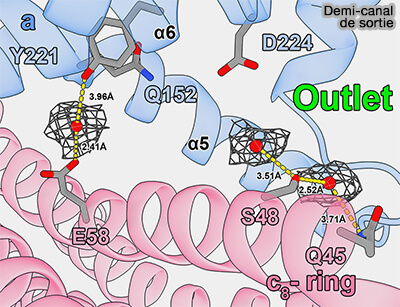
(Figure : vetopsy.fr d'après Lai et coll)
1. La libération de protons dans la matrice peut se produire :
- soit via une chaîne d’e molécules d'eau comme dans le demi-canal par transferts successifs via des résidus dans la partie supérieure de la sortie, i.e. aGlu145, aHis127, aHis223 et aAsp224 par des liaisons hydrogène,
- soit par diffusion simple dans le solvant.
2. Cependant, dans un article récent, un mécanisme Grotthuss semble être le plus probable (Structure of the human ATP synthase 2023).
- On y trouve trois molécules d'eau et plusieurs résidus polaires conservés cGln45, cSer48, cGlu58, aGln152, aTyr221 et aAsp224
- Les molécules d'eau sont coordonnées par ces résidus via de fortes liaisons hydrogène et des interactions plus faibles selon les différentes distances entre les résidus et les molécules d'eau.
Mécanisme de rotation de l'anneau c8
Bien que le mécanisme rotatif du moteur de membrane ATP synthase ne soit pas compris en détail, il est largement admis que pendant ce mécanisme, les sites de liaison du proton dans l'anneau c8 sont exposés à deux environnements distincts, auxquels ils réagissent très différemment.

Vous pouvez lire : Structural basis of proton translocation and force generation in mitochondrial ATP synthase (2017) avec de nombreuses vidéos.
1. À l'interface avec la sous-unité a/ATP6, un site de liaison protoné, i.e. avec H+, doit être capable de libérer H+ vers la matrice mitochondriale.

(Figure : vetopsy.fr d'après Symersky et coll)
2. Ce site de liaison doit se protoner avec un H+ de l'autre côté, i.e. dans l'espace intermembranaire.
- En revanche, le site de liaison d'une sous-unité c face à la bicouche lipidique doit préserver l'état protoné jusqu'à ce qu'il atteigne finalement l'interface de sous-unité a, i.e. tous les résidus sont protonés.
- Les sites de déprotonation et de protonation à l'interface des sous-unités a/c doivent être décalés spatialement et les voies d'entrée et de sortie des protons doivent déconnectées.
Si ces caractéristiques de base sont réunies, elles entraîneront un mécanisme par lequel les rotations de l'anneau c8 sont dirigées dans un sens, ici dans le sens inverse des aiguilles d'une montre, par le gradient de protons.
3. Le mécanisme pourrait le suivant et l'exemple est pris sur la levure (Structure of the c10 Ring of the Yeast Mitochondrial ATP Synthase in the Open Conformation 2012).
a. En entrant dans l’interface de la sous-unité a, un site peut adopter une conformation ouverte, et cGlu59 (couleur verte), correspondant à cGlu58, peut libérer un proton dans le canal menant à la matrice (état 1).
cGlu59 dans la sous-unité c adjacente, i.e dans le sens inverse des aiguilles d’une montre, est initialement apparié à aArg176, corespondant à aArg159 (R159), mais devient libre lorsque Arg176 passe à Glu59 déprotoné (état 2)
b. La libération de cette interaction permet au site Glu59 non engagé de charger un autre proton de l’espace intermembranaire et, finalement, de rentrer dans la membrane.
Rôles de l'ATP
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


