Neurophysiologie : synapse
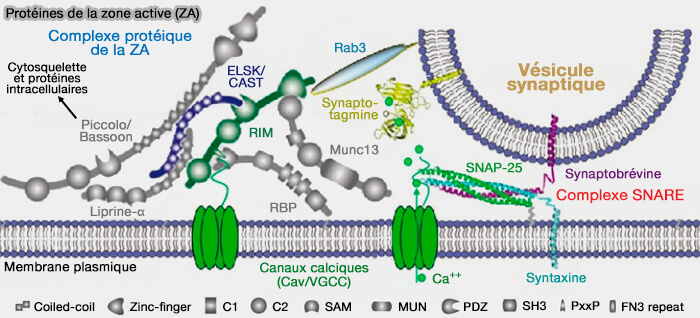
CAZ (Cytomatrix Active Zone)
RIM (Regulating synaptic membrane exocytosis protein)
Recrutement des vésicules et des canaux calciques
- Neurophysiologie
- Cellules gliales et névroglie
- Neurones
- Potentiels membranaires
- Circuits neuronaux
- Neurotransmetteurs
- Récepteurs membranaires
- Synapses

RIM (Regulating synaptic membrane exocytosis protein) est impliqué dans le recrutement des vésicules synaptiques et des canaux calciques dans la zone active (ZA).
(Figure : vetopsy.fr d'après Mochida et Wang)
Recrutement des vésicules synaptiques
Le recrutement des vésicules synaptiques (VS) est effectué par des protéines d'attache, mais RIM contribue à un recrutement plus proche de la zone active (ZA).
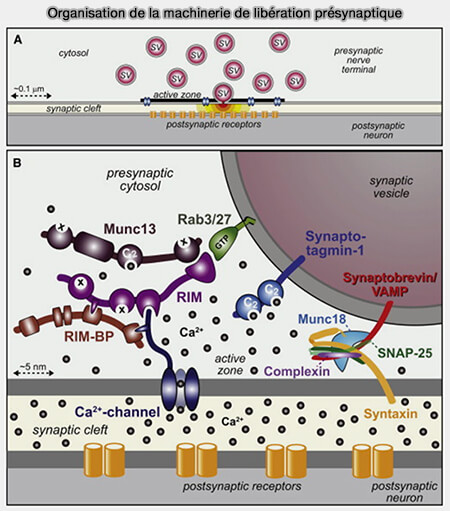
(Figure : vetopsy.fr d'après Südhof)
RIM recrute les vésicules synaptiques (VS) via les petites GTPases Rab, i.e. Rab3 et Rab27 (Critical importance of RAB proteins for synaptic function 2017 et The RAB3-RIM Pathway Is Essential for the Release of Neuromodulators 2019).

Les petites GTPases Rab sont étudiées dans un chapitre spécial.
1. Rab3 est codé par quatre gènes :
- Rab3a, Rab3b et Rab3c sont exprimés dans les VS, et Rab3a est le sous-type le plus abondant.
- Rab3d est principalement exprimée dans le pancréas, les mastocytes et les glandes parotides.
2. Rab3a se lie simultanément à l'hélice α1 et à un motif SGAWFF à la fin de l'hélice courte α2 de RIM.
Remarque : Rab27b, et non Rab27a, est exprimé dans des VS et pourrait aider Rab3 dans ses fonctions, mais son rôle n'est pas clair.
3. Munc13-1, RIM et GTP-Rab3a peuvent former un complexe (A Munc13/RIM/Rab3 tripartite complex: from priming to plasticity? 2005).
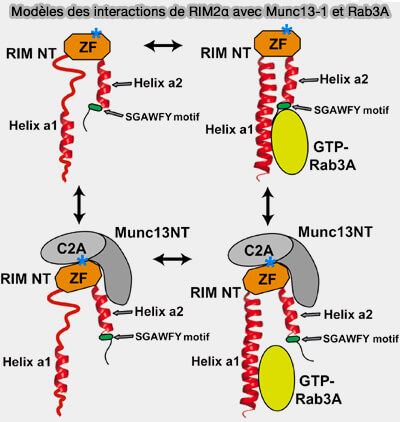
(Figure : vetopsy.fr d'après Dulubova et coll)
a. Les sites de liaison de Rab3a et Munc13-1 à RIM sont adjacents, mais séparés dans différentes régions de la séquence N-terminale de RIM.
Le domaine C2A de Munc13-1 se lie au domaine PDZ de RIM.
b. La liaison de Munc13-1 et RIM modifie les modes de liaison de RIM et de Rab3.
- Lorsque RIM se lie à Rab3a, le motif SGAWFF n'est plus nécessaire et le motif SGAWFY est libéré.
- Ceci permet la formation d'un complexe ternaire Rab3a/RIM/Munc13-1.

La formation du complexe RIM/Munc13/Rab3a est considérée comme un composant clé de l'amarrage (docking) des vésicules synaptiques.
Cette interaction peut garantir que les VS sont correctement ciblés sur la zone active (ZA) de la membrane plasmique.
Ancrage des VS à côté des Cav/VGCC
RIM ancre les vésicules synaptiques (VS) près des Cav (canaux Ca++ voltage-dépendants), appelés aussi VGCC (Voltage Gated Calcium Channels) par plusieus processus.
Vue d'ensemble
1. RIM ancre les vésicules synaptiques (VS) près des Cav/VGCC.
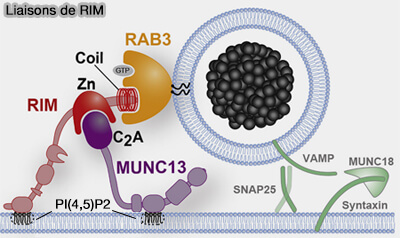
(Figure : vetopsy.fr d'après Persoon et coll)
a. D'une part, par son domaine C2B, RIM se lie au PI(4,5)P2 de la membrane présynaptique (RIM C2B Domains Target Presynaptic Active Zone Functions to PIP2-Containing Membranes 2018).
b. D'autre part, RIM se lie aux canaux Cav/VGCC directement et indirectement.
Ces canaux sont les principales voies d'afflux de Ca++ dans les terminaux axoniques et sont cruciaux pour la libération des neurotransmetteurs (Presynaptic calcium channels: specialized control of synaptic neurotransmitter release 2020).
2. Les Cav/VGCC sont classés en différents types en fonction de leur sensibilité aux changements du potentiel membranaire neuronal (
a. Dans les synapses centrales conventionnelles, la libération des neurotransmetteurs dans les synapses centrales conventionnelles dépend presque entièrement des canaux :
(Figure : vetopsy.fr)
Remarque : les canaux Cav2.3 (type R) peuvent aussi y contribuer (Presynaptic calcium channels: specialized control of synaptic neurotransmitter release 2020).
b. Dans les synapses à ruban, la libération s'effectue principalement sur les canaux Cav1 (type L).

Le rôle des Cav/VGCC dans l'électrosécrétion est étudié dans un chapitre spécial.
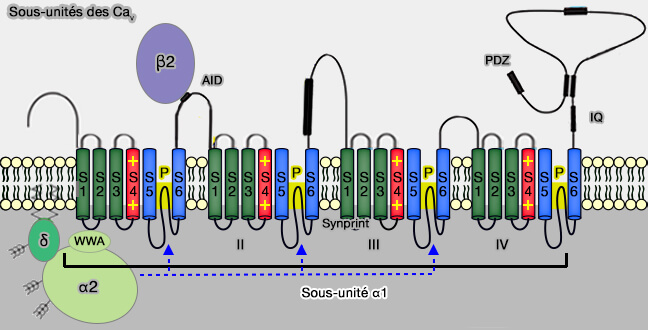
3. L'environnement des Cav/VGCC est extrêmement complexe (
RIM et recrutement des canaux Cav/VGCC
1. RIM joue un rôle important dans le recrutement des Cav/VGCC.
a. Chez les souris RIM-KO, la perte de RIM perturbe l'initiation des VS, réduit la localisation présynaptique des canaux Ca++ et élimine la libération de la plupart des neurotransmetteurs (Pushing synaptic vesicles over the RIM 2011).
b. Les protéines RIM de différents sous-types se compensent les unes les autres lors du recrutement de canaux de Ca++ vers la zone active (RIM genes differentially contribute to organizing presynaptic release sites 2012).
-
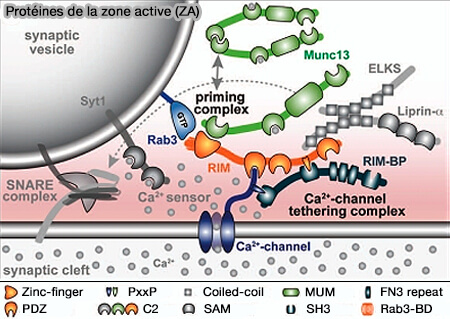
Protéines de la zone active (ZA)
(Figure : vetopsy.fr d'après Persoon et coll) - En revanche, la délétion des gènes RIM1/2 a gravement altéré la synchronisation de l'afflux de Ca++ et de la libération des vésicules.
2. Le RIM entre en interaction avec les Cav/VGCC pour un couplage rapide d'excitation-sécrétion :
- directement via son domaine PDZ (RIM Proteins Tether Ca2+ Channels to Presynaptic Active Zones via a Direct PDZ-Domain Interaction 2011).
- indirectement par les RIM-BP.
Raccourcissement de la distance VS-Cav/VGCC
Les RIM raccourcissent la distance entre les vésicules et les canaux Ca++ dans la zone active (ZA) par plusieurs processus.
Interactions directes de RIM avec les Cav/VGCC
1. La première concerne l'interaction directe entre le domaine PDZ de RIM et l'extrémité C-terminale des canaux Cav2.2, i.e. type N et Cav2.1, i.e. type P/Q, i.e. motif DxWC (Pushing synaptic vesicles over the RIM 2011 et RIM Proteins Tether Ca2+ Channels to Presynaptic Active Zones via a Direct PDZ-Domain Interaction 2011 et RIM genes differentially contribute to organizing presynaptic release sites 2012).
2. Les α-RIM interagissent également par leur domaine C2B avec la sous-unité β des Cav/VGCC (RIM1 confers sustained activity and neurotransmitter vesicle anchoring to presynaptic Ca2+ channels 2007).
-
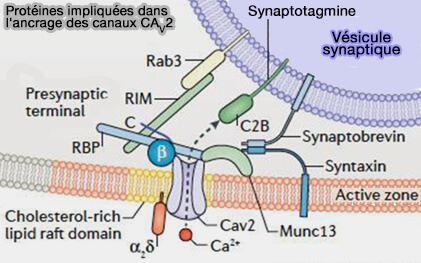
Protéines impliquées dans l'ancrage des canaux Cav2
(Figure : vetopsy.fr d'après Persoon et coll) - Le couplage fonctionnel de RIM1α à la sous-unités β est également essentiel pour la sécrétion d'insuline dans les cellules non neuronales (Functional Coupling of Rab3-interacting Molecule 1 (RIM1) and L-type Ca2+ Channels in Insulin Release 2011).
Interactions RIM/RIM-BP
1. La deuxième interaction essentielle est la liaison des séquences PxxP entre les deux domaines C2 avec le deuxième domaine SH3 de RIM-BP,
La liaison directe de RIM-BP à l'extrémité C-terminale des canaux permet aussi la localisation des Cav/VGCC (

Les RIM-BP sont étudiés dans un chapitre spécial.
2. En outre, les protéines d'échafaudage présynaptique RIM et RIM-BP forment des condensats auto-assemblés par des séparations de phase liquide-liquide ou LLPS (
Régulation des Cav/VGCC
RIM régule le temps de l'inactivation du Cav/VGCC, ce qui entraîne un afflux soutenu de Ca++ (Functional interactions between voltage-gated Ca2 + channels and Rab3-interacting molecules (RIMs): New insights into stimulus–secretion coupling 2012).
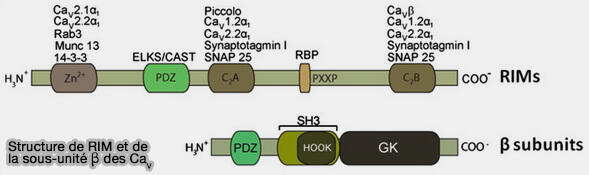
(Figure : vetopsy.fr d'après Gandini et Felix)
1. Le domaine C2B de RIM se lie à la sous-unité β des Cav/VGCC, ce qui inhibe leur inactivation et augmente indirectement la libération de neurotransmetteurs (Functional interactions between voltage-gated Ca2 + channels and Rab3-interacting molecules (RIMs): New insights into stimulus–secretion coupling 2012).
- Au repos, les canaux sont fermés.
- Pendant une dépolarisation soutenue de la membrane, les canaux subissent un changement conformationnel dans lequel la porte d'inactivation occlut le pore conducteur de l'ion.
- La présence des protéines de RIM entraîne des changements notables dans la fonction des canaux, en particulier un ralentissement significatif de la cinétique d'inactivation, comme illustré dans le schéma montrant l'évolution temporelle des traces de courant macroscopique hypothétiques à travers les canaux CAV en absence ou présence de RIM.
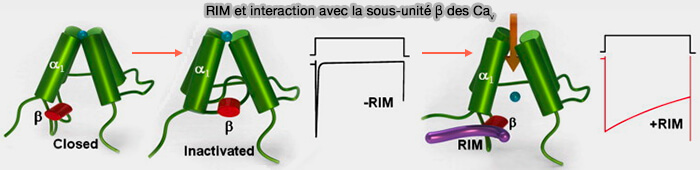
(Figure : vetopsy.fr d'après Gandini et Felix)
Remarque : les γ-RIM agissent de la même manière (Rab3-interacting Molecule γ Isoforms Lacking the Rab3-binding Domain Induce Long Lasting Currents but Block Neurotransmitter Vesicle Anchoring in Voltage-dependent P/Q-type Ca2+ Channels 2010).

(Figure : vetopsy.fr d'après Südhof)
2. En dehors du système nerveux central, des études synaptiques dans les systèmes visuel et auditif ont également montré que RIM régule les canaux Ca++ dans les terminaux synaptiques.
a. Dans les cellules ciliées de l'organe de Corti, RIM2α and RIM2β favorisent l'abondance des canaux Cav1.3 de type L (Rab3-interacting molecules 2α and 2β promote the abundance of voltage-gated CaV1.3 Ca2+ channels at hair cell active zones 2015).
Dans les cellules ciliées internes (IHC), les domaines C2B de RIM2α et RIM3γ interagissent avec l'extrémité C-terminale de la sous-unité α qui participe à la formation du pore des canaux Cav1.3 (Rab Interacting Molecules 2 and 3 Directly Interact with the Pore-Forming CaV1.3 Ca2+ Channel Subunit and Promote Its Membrane Expression 2017).
b. RIM1/2 est un régulateur important de la fonction de canal Cav1.4 dans les photorécepteurs de type bâtonnets de la souris (RIM1/2-Mediated Facilitation of Cav1.4 Channel Opening Is Required for Ca2-Stimulated Release in Mouse Rod Photoreceptors 2015).

Les effets de RIM sur la libération des canaux Ca++ et des neurotransmetteurs peuvent varier en fonction du sous-type de CAv/VGCC et du type de synapse.
Remarque : RIM intervient le plus souvent avec Bassoon, mais, quelquefois, Bassoon agit seul, en particulier semble-t-il, dans les synapses à ruban (
Rôles des RIM dans les étapes plus tardives de la fusion
NeurophysiologeCellules gliales et névroglieNeuronesPotentiels membranairesCircuits neuronauxNeurotransmetteursRécepteurs membranairesSynapsesStructure synaptiqueNeurotransmissionVésicules synaptiques (VS)Pools synaptiquesRôles du calcium dans l'électrosécrétionCycle synaptiqueTranslocation et attache (tethering)Amarrage (docking) et amorçage (priming)Fusion et exocytoseRecyclage des VSDifférents types d'endocytoseAcidification et remplissage des VSRegroupement des VSPlasticité et régulation synaptique


