Neurophysiologie : synapse
Rôle du calcium (Ca++) dans la neurotransmission
Canaux ioniques : modulation de la
décharge neuronale
- Neurophysiologie
- Cellules gliales et névroglie
- Neurones
- Potentiels membranaires
- Circuits neuronaux
- Neurotransmetteurs
- Récepteurs membranaires
- Synapses

Les canaux calciques voltage-dépendants Cav/VGCC à haute (HVA) et basse (LVA) tension et les canaux potassiques calcium-dépendants (KCa) ont un rôle essentiel dans la décharge neuronale.
Phénomènes électriques
Les canaux HVA et LVA sont des régulateurs importants des propriétés de décharge neuronale.
- les canaux à haute tension (HVA, H pour high), i.e. Cav1 et Cav2, qui s'ouvrent en réponse aux grandes dépolarisations membranaires, avec une activation entre -60 mV et -70 mV ;
- les canaux à basse tension (LVA, L pour low), i.e. Cav3 qui s'ouvrent autour de -30 mV.
1. Les canaux Cav3 (type T), qui font partie des LVA, sont activés par de petites dépolarisations membranaires (cf. plus haut).
2. Les canaux calciques Cav1.3 présentent une plage d'activation relativement hyperpolarisée et, étant donné leur localisation dendritique, il est possible que ces canaux agissent comme des canaux de type T régulant l'activité postsynaptique.
Interactions avec les canaux potassiques
Les membres des trois principales classes de canaux calciques sont des régulateurs importants des propriétés de décharges neuronales, en raison de leur contrôle sur les canaux potassiques sensibles au calcium.
Les canaux KCa font sortir le potassium du compartiment présynaptique pour aider à repolariser sa membrane.
- Les ions Ca++ qui entrent dans la terminaison présynaptique activent la partie intracellulaire de ces canaux, qui s'ouvrent et laissent sortir des ions potassium.
- Il en résulte une repolarisation rapide de la terminaison présynaptique par la fermeture des canaux calcium qui inhibe l'entrée des ions Ca++.
Interactions avec les KCa
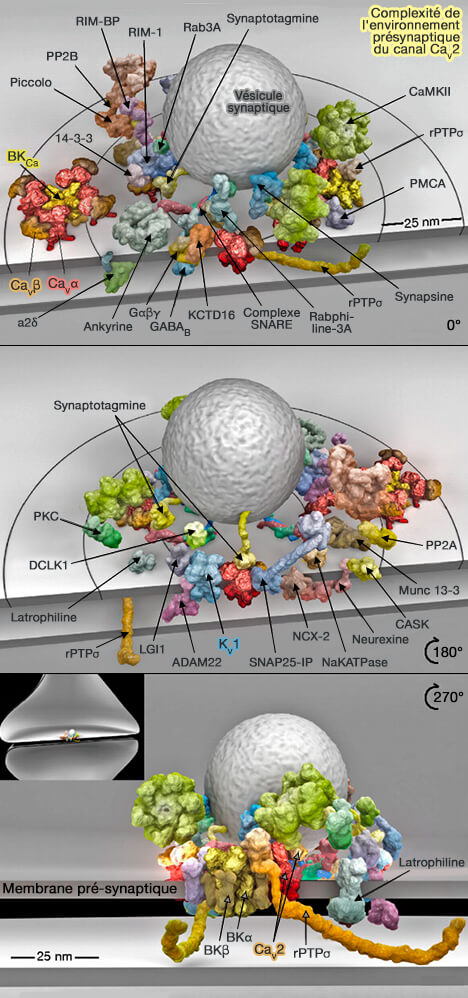
(Figure : vetopsy.fr d'après Müller et coll)
Les membres des trois principales classes de canaux calciques sont des régulateurs importants des propriétés de décharges neuronales, en raison de leur contrôle sur les canaux potassiques sensibles au calcium.
Canaux Cav3 (type T)
Les canaux Cav3 (type T) peuvent aussi interagir physiquement et fonctionnellement avec des canaux potassiques sensibles au calcium (KCa) pour former des complexes de signalisation.
1. L'entrée du calcium dans les neurones de Purkinje du cervelet, active KCa3.1 (IK), canal à conductance intermédiaire, processus qui facilite le contrôle de la sommation temporelle des entrées synaptiques (Intermediate conductance calcium-activated potassium channels modulate summation of parallel fiber input in cerebellar Purkinje cells 2012).
2. L'entrée du calcium dans les neurones vestibulaires médiaux aide à activer les canaux KCa1.1 (BK), canal à conductance élevée, pour ralentir la fréquence de déclenchement (Low Voltage Activation of KCa1.1 Current by Cav3-KCa1.1 Complexes 2013).
3. L'entrée de calcium dans les neurones réticulaires thalamiques module KCa2.1 (SK), canal à faible conductance pour réguler le comportement oscillatoire (T-type Ca2+ channels, SK2 channels and SERCAs gatesleep-related oscillations in thalamic dendrites 2008).
Les neurones réticulaires thalamiques présentent à la fois des mécanismes électrogènes, i.e une rafale de rebond, et des mécanismes dépendants du calcium par lesquels les canaux de type T modulent leurs décharges.
Canaux Cav1 et Cav2
Les canaux Cav1.2, Cav2.1 et Cav2.2 s'associent physiquement aux canaux KCa1.1 pour moduler :
- la repolarisation du potentiel d'action (Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain 2010),
- l'activité rythmique dans le cas des cellules chromaffines (Cav1.3-Driven SK Channel Activation Regulates Pacemaking and Spike Frequency Adaptation in Mouse Chromaffin Cells 2012).
Interactions avec les Kv
Dans les cellules étoilées du cervelet et peut-être aussi d'autres types de neurones, tous les types de canaux Cav3 (type T) sont capables de s'associer aux canaux potassiques Kv4.2 activés par le calcium pour former un grand complexe macromoléculaire de signalisation qui comprend également la protéine KChIP3 (Regulation of the KV4.2 complex by Cav3.1 calcium channels 2010).
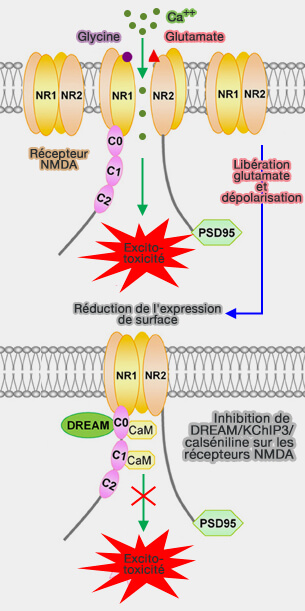
(Figure : vetopsy.fr d'après Wang et coll)
1. La protéine KChIP3 (Ca++-binding protein Kv channel interacting protein 3), appelée aussi calséniline ou DREAM (Downstream Regulatory Element Antagonist Modulator), est un membre de la famille des capteurs neuronaux de calcium (NCS), qui présente des propriétés multifonctionnelles remarquables (Global Gene Knockout of Kcnip3 Enhances Pain Sensitivity and Exacerbates Negative Emotions in Rats 2019).
- KChIP3 agit comme un répresseur transcriptionnel dans le noyau.
- KChIP3 module des canaux ou des récepteurs ioniques, tels que Kv4, les récepteurs NMDA et les canaux TRPV1 sur la cytomembrane (The DREAM Protein Negatively Regulates the NMDA Receptor through Interaction with the NR1 Subunit 2010 et FMRP mediates chronic ethanol induced changes in NMDA, Kv4.2, and KChIP3 expression in the hippocampus 2016 et KChIP3 N-Terminal 31-50 Fragment Mediates Its Association with TRPV1 and Alleviates Inflammatory Hyperalgesia in Rats 2018)
2. Pour ce qui est des interactions avec les Kv4.2, le complexe confère une sensibilité au calcium à l'inactivation de Kv4.2, entraînant :
- une augmentation de la disponibilité du canal Kv4.2 lors de l'activation du courant de type T,
- une diminution du gain de sortie (Regulation of neuronal activity by Cav3-Kv4 channel signaling complexes 2010).
Ce phénomène est extrêmement sensible au calcium, de sorte que le complexe Kv4.2/Cav3/KChIP3 peut agir comme détecteur des changements submillimolaire de la concentration en calcium (The Cav3–Kv4 Complex Acts as a Calcium Sensor to Maintain Inhibitory Charge Transfer during Extracellular Calcium Fluctuations 2013)
Retour aux canaux ioniques impliqués
dans la transmission synaptique
NeurophysiologeCellules gliales et névroglieNeuronesPotentiels membranairesCircuits neuronauxNeurotransmetteursRécepteurs membranairesSynapsesStructure synaptiqueNeurotransmissionVésicules synaptiques (VS)Pools synaptiquesRôles du calcium dans l'électrosécrétionCycle synaptiqueTranslocation et attache (tethering)Amarrage (docking) et amorçage (priming)Fusion et exocytoseRecyclage des VSDifférents types d'endocytoseAcidification et remplissage des VSRegroupement des VSPlasticité et régulation synaptique


