Neurophysiologie : synapse
Vésicules synaptiques : cycle vésiculaire
Regroupement (clustering) des vésicules
Synapsines : structure
- Neurophysiologie
- Cellules gliales et névroglie
- Neurones
- Potentiels membranaires
- Circuits neuronaux
- Neurotransmetteurs
- Récepteurs membranaires
- Synapses

Les synapsines sont des phosphoprotéines qui s'associent de manière réversible aux vésicules synaptiques (VS) et permettent de les regrouper ou de les mobiliser.
Les synapsines sont localisées dans l'amas distal des vésicules synaptiques (VS), i.e. correspondant au pool de réserve (RP), et deviennent moins abondantes près de la zone active (ZA), où se trouve le pool rapidement libérable (RRP).
- La concentration des synapsines est plusieurs fois supérieure à celle de toute autre protéine localisée dans la CAZ (Cytomatrix Active Zone).
- Les anticorps anti-synapsine éliminent le regroupement des vésicules.
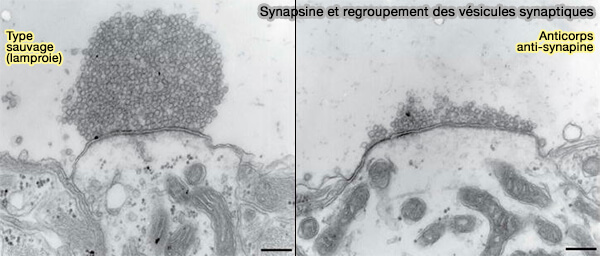 Synapsine et regroupement des vésicules synaptiques
Synapsine et regroupement des vésicules synaptiques(Figure : vetopsy.fr d'après Milovanovic et coll)

Vous pouvez lire : Synapsin condensation controls synaptic vesicle sequestering and dynamics (2024).
Structure des synapsines
Les synapsines sont des phosphoprotéines qui s'associent de manière réversible aux VS (Synapsins and the Synaptic Vesicle Reserve Pool: Floats or Anchors? 2021).
1. Les synapsines sont codées par trois gènes, i.e. SYN 1, 2, 3, dont l'épissage alternatif produit cinq membres majeurs de la famille (Synapsin Isoforms and Synaptic Vesicle Trafficking 2015).
La répartition des isoformes varie entre différents types de neurones (Synapsin Isoforms Regulating GABA Release from Hippocampal Interneurons 2016).
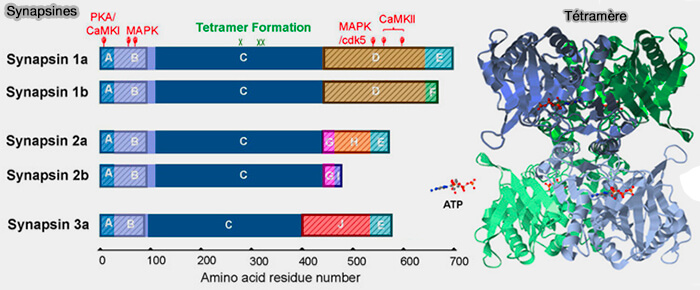
(Figure : vetopsy.fr d'après Zhang et coll)
1. Les isoformes des synapsines partagent trois domaines conservés :
a. le domaine A, i.e. résidus 1 à 28 pour la synapsine 1, ou 29 pour la synapsine 2 chez le rat, se lie avec les phospholipides.
b. le domaine B, i.e. résidu 29 pour la synapsine 1 ou résidu 30 pour la synapsine 2 aux résidus 112 chez le rat, est mal connu.
c. le domaine C, i.e. résidus 113 à 420 chez le rat, qui serait un module ATP, est le siège de la tétramérisation et se lierait aux phospholipides et au cytosquelette d'actine (Tetramerization and ATP Binding by a Protein Comprising the A, B, and C Domains of Rat Synapsin I 2004).
- En effet, en présence d'ATP, le domaine C permet la formation d'homo- ou d'hétérodimères et de tétramères de la synapsine, dépendant, chez le rongeur, de la coordination de trois résidus clés, aspartate 290 (D290), tryptophane 335 (W335) et lysine 336 (K336).
- Les peptides des domaines C ou E inhibent la formation de dimères, fournissant un mécanisme possible pour la capacité de ces peptides à perturber le RP lorsqu'ils sont injectés en terminaisons présynaptiques.
2. Les queues des synapsines, plus variables et comprennant d'importantes régions intrinsèquement désordonnées (IDR), i.e. résidus 421 à 706 dans la synapsine 1, peuvent former des gouttelettes (droplets).
- Le domaine D, riche en proline (domaine PRD), et en glutamine, des synapsines 1 se lie avec les protéines à domaine SH3.
- Le domaine E semble intervenir dans le maintien du pool de réserve (RP) et dans la synchronisation de l'exocytose, et peut-être aussi dans la dimérisation (The highly conserved synapsin domain E mediates synapsin dimerization and phospholipid vesicle clustering 2010).
- Les autres domaines trouvés, G, H, I et J ont encore des fonctions obscures.
a. Une caractéristique essentielle des protéines qui peuvent subir une LLPS, i.e. séparation de phase liquide-liquide, est leur capacité à s'engager dans des interactions multivalentes de faible affinité :
- soit par l'intermédiaire de régions intrinsèquement désordonnées (IDR),
- soit par la liaison avec des partenaires, en particulier par les interactions polyvalentes entre les protéines contenant le domaine SH3, comme l'intersectine, et les protéines hébergeant des motifs riches en proline (domaine PRD).
b. Or, la synapsine possède les deux et peut être considérée comme le régulateurse des condensats (
- De nombreuses protéines impliquées dans la formation de condensats contiennent une région intrinsèquement désordonnée (Classification of Intrinsically Disordered Regions and Proteins 2014).
- De nombreuses protéines impliquées dans le recyclage des VS contiennent de longs IDR.
3. On estime qu'un peu plus de 8 molécules sont présentes sur une vésicule synaptiques (VS), soit plus de 120 µM, ce qui représente plus de 9 % des protéines totales associées aux VS (Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins 2014).
Ces concentrations exceptionnellement élevées de synapsines dans les boutons synaptiques suggèrent qu'elles sont plus qu'un simple échafaudage modifiable pour les VS (Synaptic vesicle clusters at synapses: a distinct liquid phase? 2017).
Phosphorylation des synapsines
La stimulation soutenue des terminaux nerveux pour déclencher une libération massive de neurotransmetteurs induit également la phosphorylation Ca++-dépendante de la synapsine 1.

La phosphorylation des synapsines provoque la dissociation des vésicules synaptiques (VS) dans le cytosol, i.e. VS qui peuvent être exocytées.
Les synapsines peuvent être phosphorylées :
- par de nombreuses kinases, i.e. CaMKII (Ca++/calmodulin-dependent protein kinase II), mais aussi PKA (Protein Kinase A), Cdk5 (Cyclin-dependent kinase 5), MAPK (Mitogen-Activated Protein Kinase)
- sur 8 sites différents.
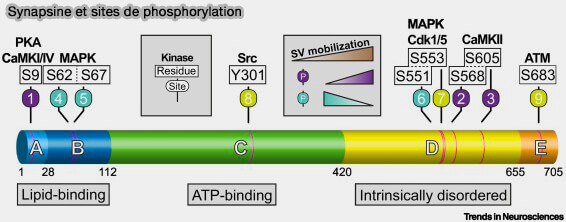
(Figure : vetopsy.fr d'après Sansevrino et coll)
1. Pendant le repos, les sites 4 à 6, i.e. Ser62, Ser67 et Ser551 dans la séquence humaine, sont phosphorylés par MAPK, et ce processus est sous le contrôle de BDNF (Brain-Derived Neurotrophic Factor).
2. Lors d’une stimulation neuronale, deux processus sont simultanés.
- D'une part, l'afflux d'ions calcium active la phosphatase calcineurine/PP2B qui élimine les groupes phosphates des sites 4 à 6.
- D'autre part, PKA phosphoryle le site 1, i.e. Ser9, et CaMKII, les sites 2-3, i.e. Ser568 et Ser605, ce qui entraîne une diminution de la liaison à la VS.
3. Une fois la stimulation terminée, deux kinases interviennent.
a. Src (proto-oncogène tyrosine kinase) phosphoryle le site 8, i.e. Tyr301, dans le domaine C qui favorise le recyclage des VS par (Tyrosine phosphorylation of synapsin I by Src regulates synaptic-vesicle trafficking 2010 et Src family kinases, adaptor proteins and the actin cytoskeleton in epithelial-to-mesenchymal transition 2021) :
- la dimérisation de la synapsine 1,
- la liaison à la VS et à l'actine.
b. Cdk5 phosphoryle les sites 6 et 7, i.e. Ser551 et Ser553, améliorant encore le regroupement des VS (Phosphorylation of Synapsin I by Cyclin-Dependent Kinase-5 Sets the Ratio between the Resting and Recycling Pools of Synaptic Vesicles at Hippocampal Synapses 2014).

La balance entre Cdk5 et la calcineurine pourrait contrôler la concentration des VS entre le pool réserve et le pool de recyclage (A Preferentially Segregated Recycling Vesicle Pool of Limited Size Supports Neurotransmission in Native Central Synapses 2012).
Remarque 1 : si le site de phosphorylation PKA dans le domaine A est conservé dans les principales isoformes, d'autres ne possèdent pas de sites de phosphorylation CaMKII et ne sont probablement pas directement modulées par CaMKII.
Par conséquent, alors que la synapsine 1a et 1b sont capables de libérer les VS du RP en réponse à la phosphorylation de CaMKII, les autres isoformes doivent s'appuyer sur la phosphorylation de la PKA (ou CaMKI) pour mobiliser les VS.
Remarque 2 : certains pensent qu'une PIK3 de classe I pourrait aussi intervenir (
Interactions avec les partenaires
NeurophysiologeCellules gliales et névroglieNeuronesPotentiels membranairesCircuits neuronauxNeurotransmetteursRécepteurs membranairesSynapsesStructure synaptiqueNeurotransmissionVésicules synaptiques (VS)Pools synaptiquesRôles du calcium dans l'électrosécrétionCycle synaptiqueTranslocation et attache (tethering)Amarrage (docking) et amorçage (priming)Fusion et exocytoseRecyclage des VSDifférents types d'endocytoseAcidification et remplissage des VSRegroupement des VSPlasticité et régulation synaptique


