Neurophysiologie : synapse chimique
Variations de structure
Synapse à ruban : otoferline
- Neurophysiologie
- Cellules gliales et névroglie
- Neurones
- Potentiels membranaires
- Circuits neuronaux
- Neurotransmetteurs
- Récepteurs membranaires
- Synapses

L'otoferline, comme les synaptotagmines, sont des senseurs calciques encodés par le gène OTOF qui joue un rôle essentiel dans le cycle des vésicules synaptiques des cellules ciliées cochléaires.
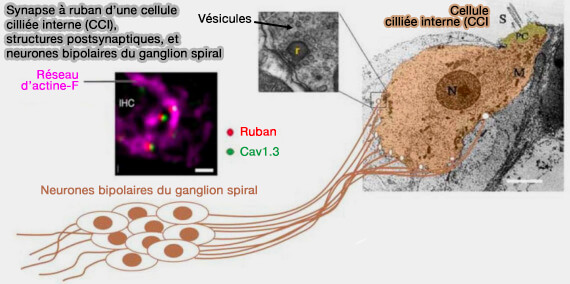
(Figure : vetopsy.fr d'après Leclère et Dulon)
Contrairement aux synapses neuronales centrales conventionnelles, les cellules ciliées internes matures (CCI) de l'organe de Corti sont dépourvues des senseurs (ou capteurs) calciques classiques, i.e. synaptotagmine I/II et Munc13, qui jouent un rôle crucial dans l'exocytose des vésicules (Unconventional molecular regulation of synaptic vesicle replenishment in cochlear inner hair cell 2015).
Les CCI, ainsi que les cellules ciliées vestibulaires, utilisent l'oterfiline dans plusieurs étapes du cycle vésiculaire en interagissant avec plusieurs partenaires (

Vous pouvez lire : Otoferlin as a multirole Ca2+ signaling protein: from inner ear synapses to cancer pathways (2023), avec de nombreuses références récentes sur le sujet.
Structure et localisation de l'otoferline
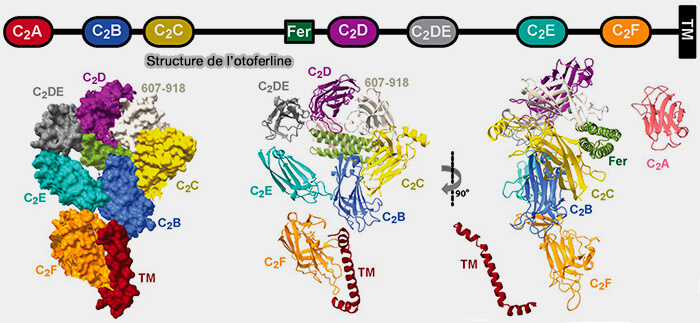
(Figure : vetopsy.fr d'après Tertrais et coll)
1. L'otoferline, grosse protéine d'environ 2 000 acides aminés, dont la composition peut varier selon les auteurs, comprend (Otoferlin as a multirole Ca2+ signaling protein: from inner ear synapses to cancer pathways 2023) :
- un seul domaine transmembranaire (TM) au niveau de sa partie C-terminale,
- un domaine FerA, ou FerB selon, faisceau à quatre hélices qui possède sa propre activité dépendante du Ca++ de liaison aux phospholipides (FerA is a Membrane-Associating Four-Helix Bundle Domain in the Ferlin Family of Membrane-Fusion Proteins 2018).
- six domaines C2 (C2-A à C2-F) qui se lient potentiellement au calcium (Ca++), et interagissent avec les phospholipides. ou 7 selon avec un rajout d'un domaine C2DE, domaine C2-like.
Chez l'homme, on trouve une isoforme courte d'otoferline (C2-DEF) dont la fonction reste inconnue (A mutation in OTOF, encoding otoferlin, a FER-1-like protein, causes DFNB9, a nonsyndromic form of deafness1999).
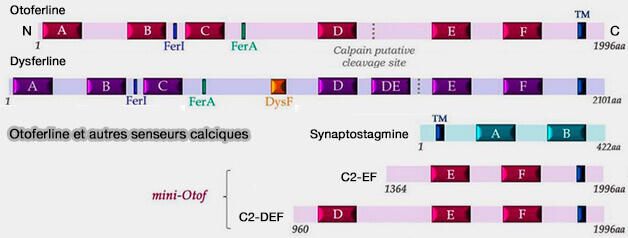
(Figure : vetopsy.fr d'après Tertrais et coll)
Remarque : la dysferline a une structure similaire, avec en plus un domaine DysF (Crystal structures of the human Dysferlin inner DysF domain 2014), et est essentielle à la fusion vésicule-membrane plasmique déclenchée par Ca++ dans les cellules musculaires squelettiques et les cardiomyocytes (Ferlins: Regulators of Vesicle Fusion for Auditory Neurotransmission, Receptor Trafficking and Membrane Repair 2011)
Les synaptotagmines, les principaux capteurs de Ca++ dans les synapses classiques du système nerveux central, ne contiennent que deux domaines C2.
(Figure : vetopsy.fr d'après Hams et coll)
2. Les domaines C2F et C2C semblent être les deux domaines les plus importants pour le cycle vésiculaire Ca++-dépendant qui reste encore à définir (Probing the role of the C2F domain of otoferlin 2023).
- Le domaine C2F et C2C semble intervenir dans l'exocytose et le réapprovisionnement des vésicules synaptiques dans la zone active (ZA) des CCI (Modes and Regulation of Endocytic Membrane Retrieval in Mouse Auditory Hair Cells 2014).
- Le domaine C2C semble aussi important pour maintenir la présence de l’otoferline dans les membranes plasmiques via son interaction avec les phospholipides.
3. Une mini-Otof formée des domaines C2E-C2F permet la restauration d'une exocytose rapide partielle associée à une endocytose ultrarapide ou UFE (Viral Transfer of Mini-Otoferlins Partially Restores the Fast Component of Exocytosis and Uncovers Ultrafast Endocytosis in Auditory Hair Cells of Otoferlin Knock-Out Mice 2019).
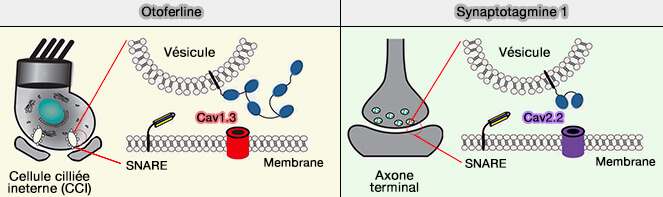
Fonctions de l'otoferline et localisation
(Figure : vetopsy.fr d'après Chakrabarti et coll)
L'otoferline joue un rôle crucial dans l'audition dans les synapses à ruban des cellules ciliées internes ou CCI (Otoferlin as a multirole Ca2+ signaling protein: from inner ear synapses to cancer pathways 2023).
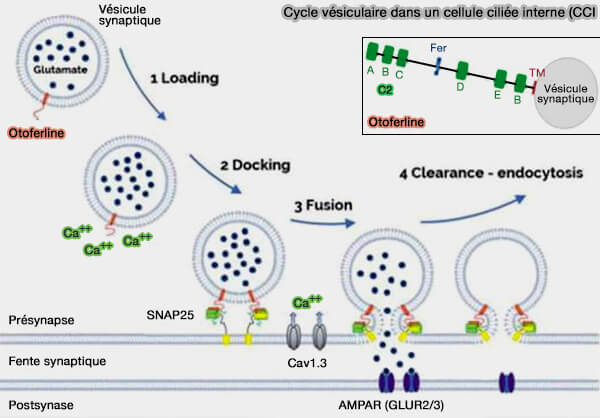
(Figure : vetopsy.fr d'après Leclère et Dulon)
1. L'otoferline, senseur calcique comme les synaptotagmines, est indispensable à plusieurs étapes du cycle vésiculaire des CCI, en interagissant avec plusieurs partenaires (
- l'attache (tethering), l'amarrage (docking) fonctionnel et l'amorçage (priming),
Chez les souris KO pour l'otoferline, la longueur moyenne d'attache entre les vésicules et la zone active est augmentée, ce qui suggère un possible défaut d'attache et d'amorçage des vésicules (Unconventional molecular regulation of synaptic vesicle replenishment in cochlear inner hair cells 2015).
- la fusion membranaire et l’exocytose des vésicules déclenchée par le calcium en aval,
Chez les souris KO pour l’otoferline, la fusion est presque complètement bloquée (Otoferlin acts as a Ca2+ sensor for vesicle fusion and vesicle pool replenishment at auditory hair cell ribbon synapses 2017).
- l'endocytose,
- éventuellement le transport et la maturation des vésicules (Viral Transfer of Mini-Otoferlins Partially Restores the Fast Component of Exocytosis and Uncovers Ultrafast Endocytosis in Auditory Hair Cells of Otoferlin Knock-Out Mice 2019).
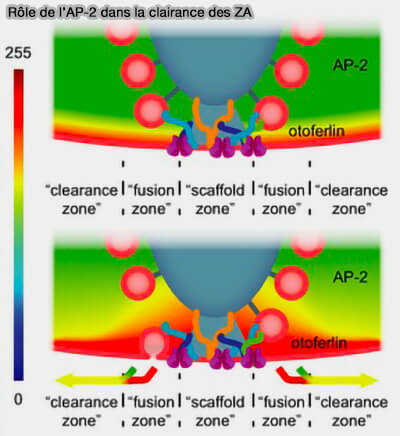
(Figure : vetopsy.fr d'après Jung et coll)
2. L'otoferline est également impliquée dans la clairance des zones actives (ZA), y compris le transport du matériel exocytaire, via des interactions avec (Disruption of adaptor protein 2μ (AP‐2μ) in cochlear hair cells impairs vesicle reloading of synaptic release sites and hearing 2015) :
- l'AP-2 μ,
- une protéine motrice,
- une GTPase.
Mécanisme
La forme complète à six domaines C2 est indispensable à la fois pour la fusion rapide des vésicules, mais également pour leur recrutement.
1. La forme complète multiplie ses liaisons de façon simultanée à la fois :
- à la membrane vésiculaire,
- aux canaux calciques (Cav1.3),
- aux protéines SNARE sur la membrane présynaptique (Otoferlin is a multivalent calcium-sensitive scaffold linking SNAREs and calcium channels 2017 et Characterization of the Lipid Binding Properties of Otoferlin Reveals Specific Interactions between PI(4,5)P2 and the C2C and C2F Domains 2014).
2. De plus, la forme complète favorise les interactions entre domaines C2 qui pourraient alors former une structure tertiaire fermée à faible concentration calcique, qui s’ouvrirait lors de l’augmentation calcique suivant la dépolarisation cellulaire (Calcium Regulates Molecular Interactions of Otoferlin with Soluble NSF Attachment Protein Receptor (SNARE) Proteins Required for Hair Cell Exocytosis 2014).
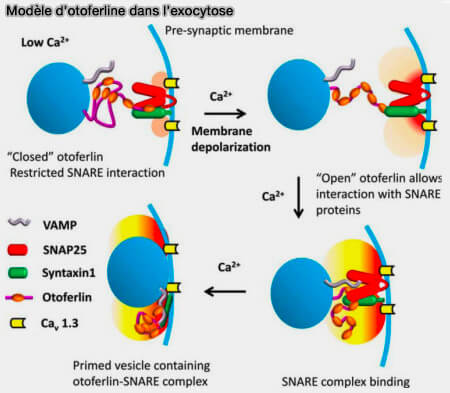
(Figure : vetopsy.fr d'après Eatcock et coll)
Ces états fermés et ouverts des senseurs calciques ont également été proposés pour les domaines C2-A et C2-B des synaptotagmines (
3. L’absence d’otoferline dans les CCI est associée à l’absence de la composante rapide de l’inactivation du courant Ca++ et à une diminution de l’expression des canaux Cav1.3S (Different CaV1.3 Channel Isoforms Control Distinct Components of the Synaptic Vesicle Cycle in Auditory Inner Hair Cells 2017).
Des interactions directes entre la boucle cytoplasmique II–III de Cav1.3 et l'otoferline, via les domaines C2-D ou C2-ABDF de l'otoferline, ont été suggérées (Otoferlin is a multivalent calcium-sensitive scaffold linking SNAREs and calcium channels 2017).
a. Les isoformes courtes Cav1.3S à inactivation rapide, 25% du courant calcique total des CCI, sont étroitement associées au site de libération des rubans synaptiques et piloteraient l'exocytose des vésicules synaptiques (VS) du pool rapidement libérable (RRP), VS amarrées (docking) au niveau de la membrane cellulaire des CCI au niveau des ZA et amorcées (priming) pour être prêtes à la fusion.
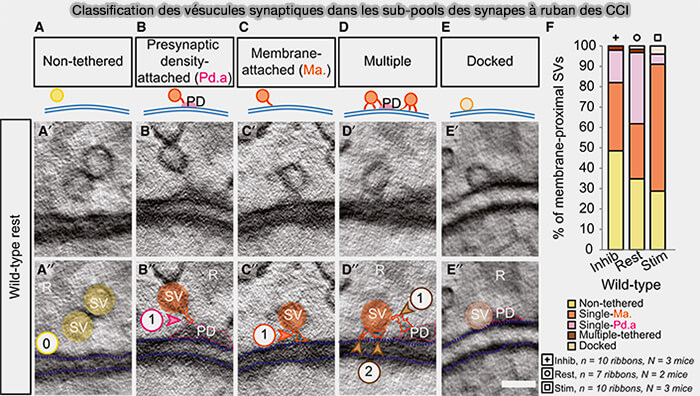
(Figure : vetopsy.fr d'après Chakrabarti et coll)
b. Les isoformes longues Cav1.3L, à inactivation longue, qui transportent environ 75 % du courant calcique total sont essentiellement impliquées dans le recrutement des VS à libération lente (SRP).
La réduction d'inactivation de la sous-unité CaV1.3L est due à la présence, à son extrémité C-terminale, de deux domaines régulateurs proximaux à hélice α (PCRD) et distaux (DCRD) qui interagissent entre eux pour former le domaine régulateur C-terminal (CTM).

L'otoferline est une protéine multivalente capable de se lier simultanément à de multiples copies de la boucle cytoplasmique des protéines Cav1.3 et aux protéines SNARE.
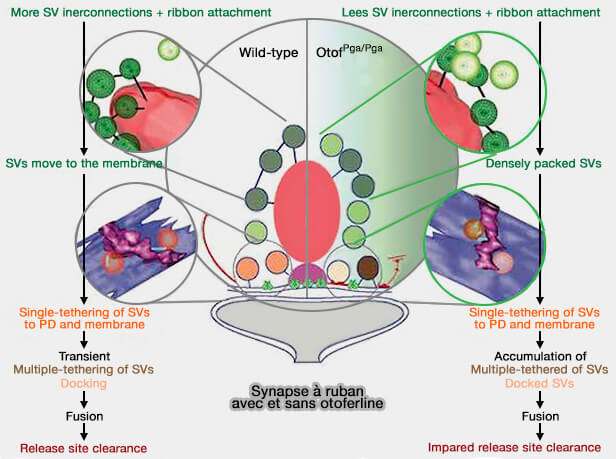
Modèle de cycle vésiculaire
Les vésicules synaptiques (VS) sont attachées par plusieurs filaments au ruban synaptique.
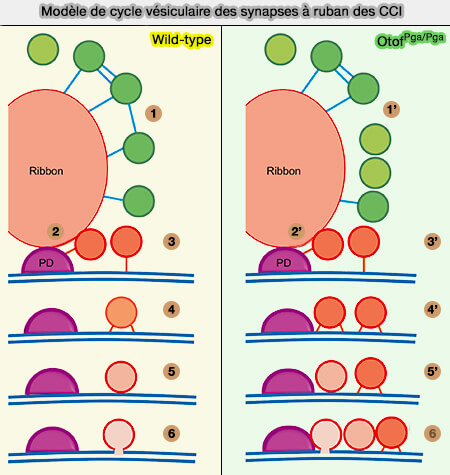
(Figure : vetopsy.fr d'après Jung et coll)
a. Dans le type sauvage des cellules ciliées internes (CCI) :
- (1) Après stimulation, (2) les VS sont transportées vers la densité présynaptique (PD).
- (3). Après une seule attache à la zone active (ZA), (4). on assiste à la formation d'attaches multiples.
- (5). Après l'amarage (docking), (6). la fusion se produit.
b. Dans le type OTOFPGA /PGA :
- (1) Après stimulation, certaines VS ne sont pas attachées par des filaments (2) et les VS sont transportées vers la densité présynaptique (PD).
- (3). Après une seule attache à la zone active (ZA), (4). on assiste à une accumulation de VS à attaches multiples.
- (5). Après l'amarage (docking) de certaines vésicules, (6). la fusion se produit alors que le autres encombrent la PD par une clairance déficiente.
Retour aux synapses à ruban ou à la tansduction auditive
En construction


