Domaines protéiques liés à l'ubiquitine
UBR-Box et N-domaine

Les UBR-box et les N-domaines sont inclus dans les N-recognins qui reconnaissent les N-dégrons de l'Arg/règle N-terminale.
La voie de la règle du N-terminal (N-end rule) est un système protéolytique : la déstabilisation de certains résidus N-terminaux peut donner un signal pour la destruction de la protéine par le protéasome 26S : elle nécessite une ubiquitination chez les eucaryotes.
N-recognins (N-recognin)
1. Les N-recognins sont des protéines spécialisées dans la détection et la liaison sélective des N-dégrons de l'Arg/règle N-terminale (Arg/N-end rule, i.e.des signaux N-terminaux déstabilisants conduisant à l’ubiquitination et à la dégradation du substratut (The Substrate Recognition Domains of the N-end Rule Pathway 2009 et The N-end rule pathway: From recognition by N-recognins, to destruction by AAA + proteases 2012).
Elles possèdent deux domaines principaux assurant la reconnaissance des différents types de N-dégrons :
- Les UBR-box qui reconnaissent les N-dégrons de type 1, comportant les acides aminés arginine, lysine et histidine, les résidus cystéine, asparagine et glutamine sont préalablement convertis en acides aminés de type 1).
-
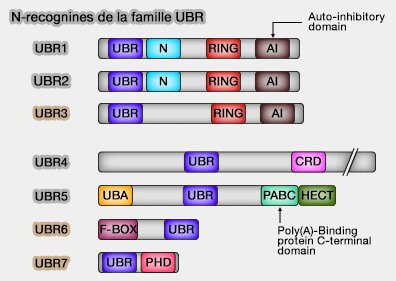
Protéines UBR
(Figure : vetopsy.fr)
Remarque : d’autres variantes de la règle du N-terminal, telles que l’Ac/règle N-terminale (Ac/N-end rule) ou la leu/N-end rule bactérienne, illustrent la conservation évolutive de ce mécanisme de reconnaissance, bien qu’elles impliquent d’autres systèmes enzymatiques.
2. Les protéines UBR sont des E3 ubiquitine ligases qui comptent 7 membres chez les mammifères (1 seul chez la levure).
a. UBR 1/2/4 sont de véritables N-recognins, contenant une UBR-box fonctionnelle et un domaine catalytique Ring, leur permettant de reconnaître et d’ubiquitiner les N-dégrons de type 1 et de type 2 (A Family of Mammalian E3 Ubiquitin Ligases That Contain the UBR Box Motif and Recognize N-Degrons 2005).
b. UBR5 (EDD1), bien que classée parmi les N-recognins, possède un domaine catalytique de type HECT actif et ne reconnaît que les N-dégrons de type 1.
c. UBR3, UBR6 et UBR7, bien qu’elles contiennent également une UBR-box, ne possèdent pas d’activité N-recognin ( (The Substrate Recognition Domains of the N-end Rule Pathway 2009).
| Protéine UBR | Domaine catalytique |
Recon- naissance |
Principales fonctions |
Particularités |
|---|---|---|---|---|
| Sous-groupe N-recognin actif | ||||
| UBR1 | RING | N-dégrons (type 1 et 2) |
|
|
| UBR2 | RING | N-dégrons (type 1 et 2) |
|
Impliquée dans la réponse au stress et la différenciation germinale |
| UBR4 | RING | N-dégrons (type 1 et 2) |
|
Très grande protéine (plus de 5000 aa) impliquée dans l'organisation du cytosquelette |
| UBR5 (EDD1) |
HECT | N-dégrons (type 1) |
|
|
| Sous-groupe non N-recognin/paralogue divergent | ||||
| UBR3 | RING (inactif) |
|
UBR-box non fonctionnelle | |
| UBR6 (FBXO11) |
RING (F-box) |
|
Fonction plus proche des complexes CRL que des N-recognins |
|
| UBR7 | RING (PHD-finger) |
|
Contient un domaine PHD associé à l'activité E3 nucléaire |
|
UBR-Box
1. la structure de l'UBR-Box, d'environ 70 à 80 acides aminés, est composée (Structural basis for the recognition of N-end rule substrates by the UBR box of ubiquitin ligases 2010 et Structural basis of substrate recognition and specificity in the N-end rule pathway 2010 et The UBR-box and its relationship to binuclear RING-like treble clef zinc fingers 2015) :
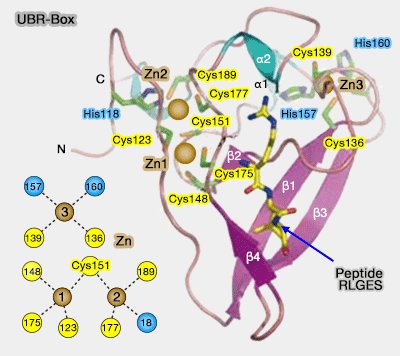
(Figure : vetopsy.fr d'après Choi)
a. d'un coeur compact avec trois sites de chélation du zinc
b. d'une forme en V, délimitée par deux brins β (β strand) antiparallèles et deux boucles irrégulières.
Les UBR humaines contiennent 2 hélices α, et les levures 3 hélices 310.
c. La structure du domaine U-box est proche du domaine RING (
2. Les UBR se lient et reconnaissent les N-dégrons de type 1, i.e. les arginine, lysine ou histidine N-terminales.
- Tous les résidus de la UBR-box semblent nécessaires et suffisants pour la liaison (The N-End Rule Pathway 2012).
- Par contre, la mutation de Asp150 semble abolir complètement la liaison au substrat (ici, peptide RLGES).
N-domaine
Le N-domaine est une région adjacente à l'UBR-box des N-recognins qui reconnaît les N-dégrons de type 2 (leucine, isoleucine, phénylalanine, tryptophane et tyrosine).
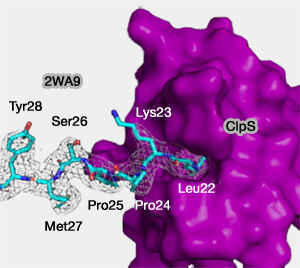
(Figure : vetopsy.fr d'après Roman)
1. Ce N-domaine d'environ 80 résidus présente une similitude structurelle et fonctionnelle avec la N-recognin d'Escherichia coli, ClpS (appelée aussi ATP-dependent Clp protease adaptor protein).
Chez la levure, cette Clps se lie au N-dégron et présente la protéine à la protéase ClpAP ATP-dépendante (The ClpS Adaptor Mediates Staged Delivery of N-End Rule Substrates to the AAA+ ClpAP Protease 2011).
2. Par contre, contrairement à l'UBR-box, le N-domaine seul ne suffit pas à la liaison au substrat, ce qui laisse supposer que certains résidus spécifiques de ce domaine doivent être proches de la structure tridimensionnelle de l'UBR-box.
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


