Microfilaments d'actine
Polymérisation in vivo par le complexe Arp2/3
NPF : régulations
- En construction

Les NPF (Nucleation Promoting Factor) sont régulés spatialement et temporellement par plusieurs processus complexes.
Les NPF (Nucleation Promoting Factor) sont activés par un grand nombre de facteurs chimiotactiques ou de protéines de voies de signalisation, comme la voie Wnt avec les GTPases Rho pour activer le complexe Arp2/3 (Molecular regulation of cytoskeletal rearrangements during T cell signalling p: 219).
Les NPF provoquent des modifications de conformation, qui touchent tous les domaines (New mechanisms and functions of actin nucleation 2011).
Leur régulation spatiale et temporelle dépend de plusieurs processus (A Nucleator Arms Race: Cellular Control of Actin Assembly 2010).
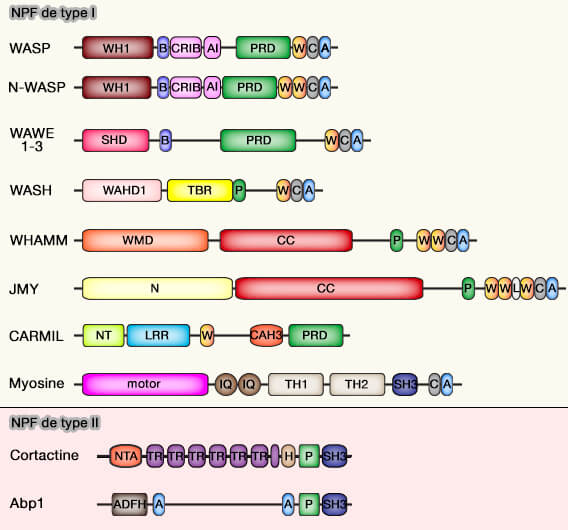
(Figure : vetopsy.fr)
Accès au domaine VCA/WCA
L'accès au domaine VCA/WCA est la régulation principale.
WASP et N-WASP
Pour les WASP et N-WASP, deux régulations sont décrites.
Auto-inhibition des WASP
Le domaine VCA des WASP est auto-inhibé par des interactions moléculaires avec des domaines en amont du NPF (Generation of branched actin networks: assembly and regulation of the N-WASP and WAVE molecular machines 2010).

L'auto-inhibition des WASP par le domaine GBD est étudiée dans un chapitre spécial.
1. Cette auto-inhibition de VCA est dépendante :
- du domaine GBD (GTPase-Binding Domain), i.e. domaine CRIB (Cdc42/Rac-Interactive Binding) et auto-inhibitreur (AI),
- d'une hélice αG du domaine C.
Le domaine GBD est retrouvé dans de nombreux effecteurs des petites GTPases et se lie à Cdc42 et Rac sous leur forme GTP (The nucleotide switch in Cdc42 modulates coupling between the GTPase-binding and allosteric equilibria of Wiskott–Aldrich syndrome protein 2005).
- Ces domaines auto-inibitent les WASP en contactant le domaine VCA.
- La fente hydrophobe du domaine GBD interagit avec la face hydrophobe de l'hélice amphipathique du domaine C pour masquer le site VCA.
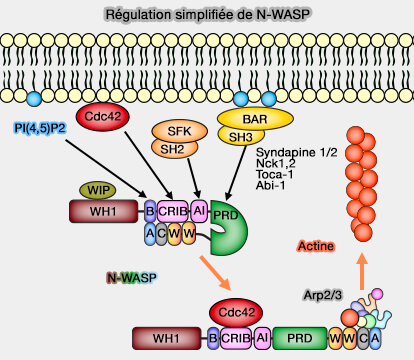
2. L'activation de la RhoGTPase Cdc42 libère le domaine VCA avec la phosphorylation des protéines WIP.
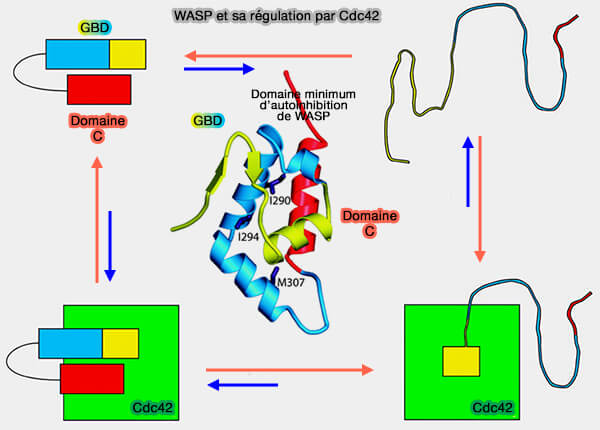
(Figure : vetposy.fr d'après Leung et coll)
3. Les WASP établissent un contact intensif avec les régions Switch/α2 des Rho GTPases, ce qui indique que cette région sert probablement de plate-forme pour la reconnaissance des effecteurs dépendants du GTP.
Protéines WIP
Les WIP (WAS/WASL Interacting Protein) comprennent plusieurs membres :
- WIP,
- CR16 (Corticosteroids and Regional expression-16),
- WICH/WIRE (WIP- et CR16-homologous protein/WIP-related).

Les WIP sont des protéines F-Bar qui se fixent sur le domaine WH1 des WASP.
Structure des WIP
(Figure : vetopsy.fr)
Ces protéines contiennent plusieurs domaines (WIP: WASP-interacting proteins at invadopodia and podosomes 2012).
1. Le domaine V (verprolin domain) contient 2 domaines WH2 (WASP homology 2) qui se lient à l'actine, ce qui facilite la stabilisation des microfilaments.
2. Des domaines ABM-2 (Actin-Based Motility 2), se lient à la profiline, i.e. de 2 à 6 suivant les WIP.
3. Le domaine riche en proline (PRD) se lie au domaine SH3 de la cortactine et de l'Abp-1 (Actin-Binding Protein-1) ou aux adaptateurs Nck or CrkL.
4. Le domaine WBD (WIP-Bindind Domain) se lie à WASP et à N-WASP.
Mécanisme des WIP sur les WASP
1. Dans les cellules, WIP forme un complexe avec WASP et N-WASP, i.e. même phosphorylés, donc actifs, par la liaison entre le domaine WBD et WH1 pour les protéger de la dégradation par les protéasomes.
a. La phosphorylation par la famille Src des tyrosine kinases, en particulier tyrosine kinase de Bruton (Btk), joue un rôle crucial dans le développement des lymphocytes B, dans le domaine WBD des WIP, de trois résidus tyrosine (Y455, Y468 et Y 475) dissocie le complexe WASP-WIP.
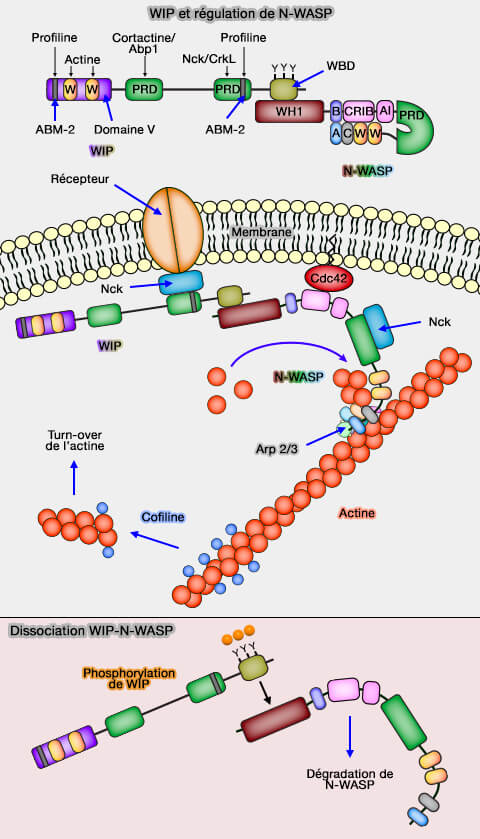
(Figure : vetopsy.fr)
b. La libération de WASP du complexe provoque sa dégradation dans les protéasomes (par la calpaïne et l'ubiquitine) et, inhibe, de ce fait la polymérisation des microfilaments d'actine.

Vous pouvez lire : Tyrosine phosphorylation of WIP releases bound WASP and impairs podosome assembly in macrophages (2015).
2. Après la stimulation cellulaire, la levée de l'autoinhibition et l'exposition des domaines VCA pour activer le complexe Arp2/3 sont dues à plusieurs processus.
a. WIP se lie aux adaptateurs CrkL ou Nck rqui ecrute le complexe vers la membrane plasmique.
b. Le domaine CRIB se lie au Cdc42, mais pas au Rac1.
c. WASP est phosphorylé sur plusieurs résidus.
- La tyrosine 291 (ou Y293 chez la souris) semble réguler l'activation du complexe Arp2/3, i.e. la liaison avec Cdc42 (Phosphorylation of WASp is a key regulator of activity and stability in vivo 2009 et Tyrosine phosphorylation of WASP promotes calpain-mediated podosome disassembly 2012),
- Les sérines 483 et 484 semblent être nécessaires pour l'association avec le complexe Arp2/3 (Phosphorylation of the WASP-VCA Domain Increases Its Affinity for the Arp2/3 Complex and Enhances Actin Polymerization by WASP 2003).
(Figure : vetopsy.fr)
Remarque : La phosphorylation de la Ser488, situé avant le domaine WBD, par la PKCθ en réponse à l'activation du récepteur des cellules T ne provoque pas la dissociation du complexe comme cela avait été décrit auparavant.
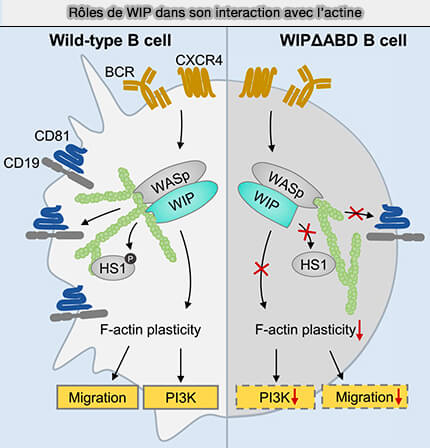
Interactions des WIP avec l'actine
WASP est le régulateur cytosquelettique principal dans les lymphocytes B.
WIP se lie et stabilise WASP, mais interagit également avec l'actine et cette liaison, indépendamment de sa liaison à WASP, est essentielle pour la plasticité du cytosquelette d'actine dans les cellules B (The Lack of WIP Binding to Actin Results in Impaired B Cell Migration and Altered Humoral Immune Responses 2018).
- La liaison de WIP à l'actine influence la phosphorylation du CD19 et la signalisation PI3K.
- La réorganisation de l'actine et la localisation HS1/HCSL1 (Hematopoietic Cell-Specific protein-1) sont perturbés dans les cellules B mutantes WipΔABD (Hematopoietic cell-specific lyn substrate (HCLS1 or HS1): A versatile actin-binding protein in leukocytes 2018)
- La plasticité de l'actine défectueuse entraîne une chimiotaxie et une migration réduites.
- La liaison de WIP à l'actine dans les cellules B façonne les réponses immunitaires humorales.
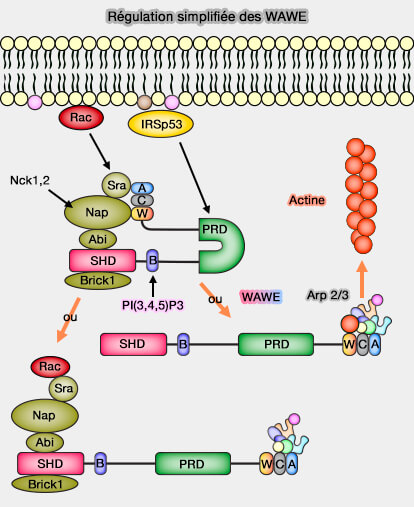
WAVE
1. Le complexe WAVE est sous forme hétéropentamérique.
- La fixation de Rac1, sous sa forme GTP, sur Sra1/PIR121 (ou CYFIP2) recrute le complexe (Activation of the WAVE complex by coincident signals controls actin assembly 2009 et The WAVE Regulatory Complex is Inhibited 2009).
- Nap peut se lier au domaine SH3 de l'adaptateur protéique Nck.
2. La régulation n'est pas aussi simple car de nombreuses autres composants peuvent intervenir (WAVE signalling: from biochemistry to biology 2006) :
- une Rho GAP pour WAVE1, i.e. WRP,
- de nombreuses kinases,
- `P(3,45)iP3
(Figure : vetopsy.fr)
3. Comme pour les WASP, son activation est régulée par la phosphorylation du domaine VCA par des kinases.
a. WAVE2 est phosphorylée par :
- ERK2 (Extracellular signal-Regulated Kinase 2),
- c-Abl (Abelson-interactor-1 promotes WAVE2 membrane translocation and Abelson-mediated tyrosine phosphorylation required for WAVE2 activation 2005),
- CK2 ou Caséine Kinase 2 (WAVE2 is regulated by multiple phosphorylation events within its VCA domain 2009)].
b. WAVE1 est phosphorylé par Cdk5 (Cyclin-dependent kinase 5), ce qui inhibe l'activation du complexe Arp2/3 (Phosphorylation of WAVE1 regulates actin polymerization and dendritic spine morphology 2006).
4. Le domaine VCA est exposé et peut activer le complexe Arp2/3 (The WAVE Regulatory Complex is Inhibited 2009).
Cette polymérisation est très rapide car elle multiplient les extrémités (+).
Autres régulations
1. La dimérisation du domaine VCA/WCA peut également se produire.
Cette dimérisation augmente l'affinité des NPF pour l'Arp2/3 de 180 fois environ (Hierarchical Regulation of WASP/WAVE Proteins 2008).
2. L'activation semble aussi faire intervenir des protéines à domaine SH3.
En particulier, les protéines contenant le domaine F-Bar ou I-BAR sont elles aussi localisées sur la membrane par leur affinité avec phospholipides, et leur domaine SH3 peut se lier au domaine riche en proline (PRD) des NPF.
Retour au complexe Arp/2/3
En construction


