Domaine des protéines
Domaines protéiques d'interaction membranaire
Domaine FERM

Le domaine FERM (F pour band 4.1, E pour Ezrine, R pour Radixine et M pour moésine) est un module protéique impliqué dans la localisation des protéines dans la membrane plasmique.
(Figure : vetopsy.fr d'après Hamada et coll)
Le domaine FERM en tant que module globulaire riche en cystéine et basique permet des interactions protéine-protéine et protéine-lipide, qui déterminent l'activité et la spécificité de la protéine contenant un domaine FERM (FDCPou FERM Domain–Containing Protein).
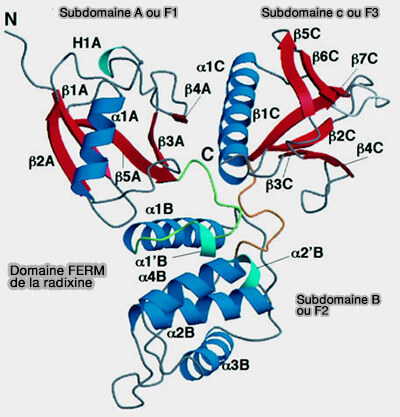
Structure du
domaine FERM
Le domaine FERM est situé au niveau de l'extrémité N-terminale des protéines.
1. Le domaine FERM contient trois lobes, F1, F2, et F3 (ou A, B, et C), qui forment une structure compacte en forme de trèfle (Structural basis of the membrane-targeting and unmasking mechanisms of the radixin FERM domain 2000).
- Le sous-domaine F1 ressemble à l'ubiquitine dans sa structure.
- Le sous-domaine F2 a un pli protéique similaire à celui de la protéine de liaison acyl coenzyme A (acyl-CoA).
- Le sous-domaine F3 est similaire en structure aux domaines PH/PTB, connus pour lier les phosphoinositides phosphorylés.
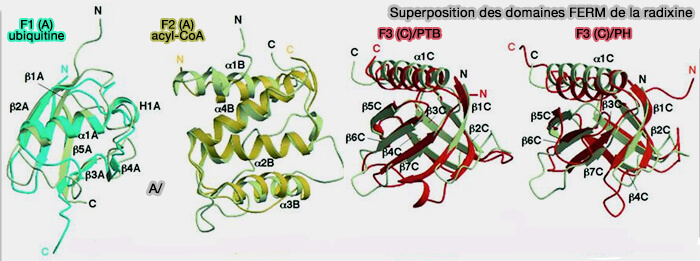
(Figure : vetopsy.fr d'après Hamada et coll)
Rôle du domaine FERM
1. De nombreuses protéines contiennent un domaine FERM (
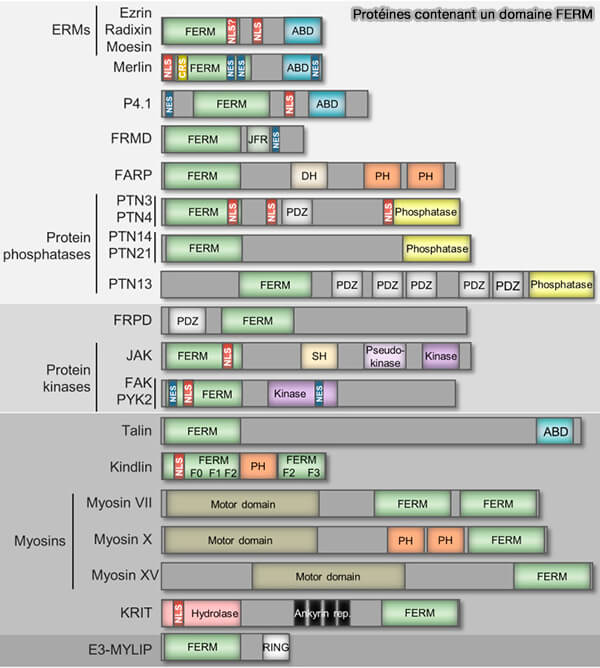
(Figure : vetopsy.fr d'après Borkúti et coll)
2. Les molécules de liaison les plus importantes du domaine FERM sont :
- les récepteurs transmembranaires,
- les intégrines,
-
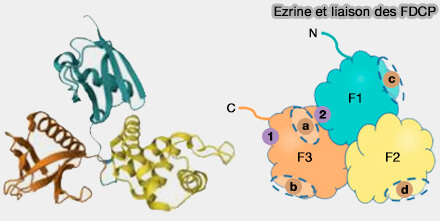
Ezrine et liaison des FDCP
(Figure : vetopsy.fr d'après Borkúti et coll) - PI(4,5)P2.
3. Les liaisons sont indiquées sur la figure ci-contre :
- (1 et 2), liaisons IP3/PI(4,5)P transitoire (1) et stable (2),
- (a) moesine et Crumbs par exemple
- (b) radixine et EBP50
- (c) radixine et MT1-MMP
- (d) Merlin et Last1
4. Dans vetopsy.fr, on peut trouver des exemples détaillés de protéines comme dans :
- les nexines, comme SNX27,
- la taline, à configuration spéciale, i.e. un domaine F0 précède F1 et qui, comme lui, possède un repli ubiquitine-like,
- la kindline,
- les myosines…
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


