Glucides
Glycosylation
: C-glycosylation
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La C-glycosylation est une glycosylation récemment découverte.
Vue d'ensemble
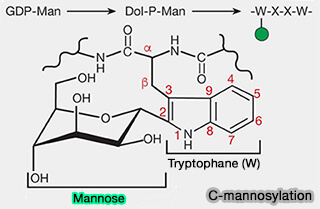
(Figure : vetopsy.fr d'après Varki et coll)
La C-glycosylation, i.e. en particulier la C-mannosylation, est rare car la liaison glycosidique est une liaison $\ce{C-C}$, plutôt que $\ce{C-O}$ ou $\ce{C-N}$.
1. L'atome C1 d'un résidu unique de mannose est ajouté en liaison α à l'atome C2 du fragment indole du tryptophane (W) dans les protéines cibles pour former, avec le mannose, le C-mannosyl tryptophane (Protein C-Mannosylation and C-Mannosyl Tryptophan in Chemical Biology and Medicine 2021).
2. Les sites de glycosylation (motif WXXW/C) se trouvent sur :
- les protéines avec TSR (ThromboSpondin type-1 Repeat) comme certaines protéines du complément, i.e. C6, C7, C8, et C9, et la properdine par exemple dans laquelle 14 des 17 sites consensus sont modifiés.
- les récepteurs de cytokines de type I.
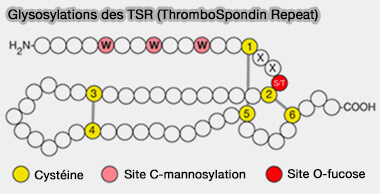
(Figure : vetopsy.fr d'après Varki et coll)
3. Cette C-glycosylation, de découverte récente, se produirait avant ou pendant le repliement des protéines dans le réticulum endoplasmique (RE).
Remarque : une O-fucosylation survient aussi sur la sérine/thréonine entre la première et la deuxième cystéine des TSR (ThromboSpondin type-1 Repeat), répétitions contenant aussi 6 cystéines avec 3 ponts disulfure (Crystal structure of the TSP-1 type 1 repeats 2002).


