Fusion vésiculaire : protéines SNARE
Régulation des protéines SNARE
Modèles de régulation par les synaptotagmines et la complexine (4-5-6)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Les protéines des familles synaptotagmine et complexine constituent une classe de régulateurs des protéines SNARE qui sont particulièrement importants dans les événements de fusion déclenchés par le calcium.
(Figure : vetopsy.fr d'après Park et Ryu)
Différents modèles controversés, mais qui peuvent se chevaucher partiellement, ont été formulés pour expliquer comment la synaptotagmine-1 (Syt1) et la complexine (Cplx) couple la liaison Ca++ à la fusion membranaire (Models of synaptotagmin-1 to trigger Ca2+-dependent vesicle fusion 2018).
Certains modèles sont probables et ne s'excluant pas forcément :
- Modèle 1 : déverrouillage des SNARE par Syt1 en déplaçant Cplx,
- Modèle 2 : courbure de la membrane par Syt1,
- Modèle 3 : oligomérisation circulaire.
D'autres modèles sont moins probables :
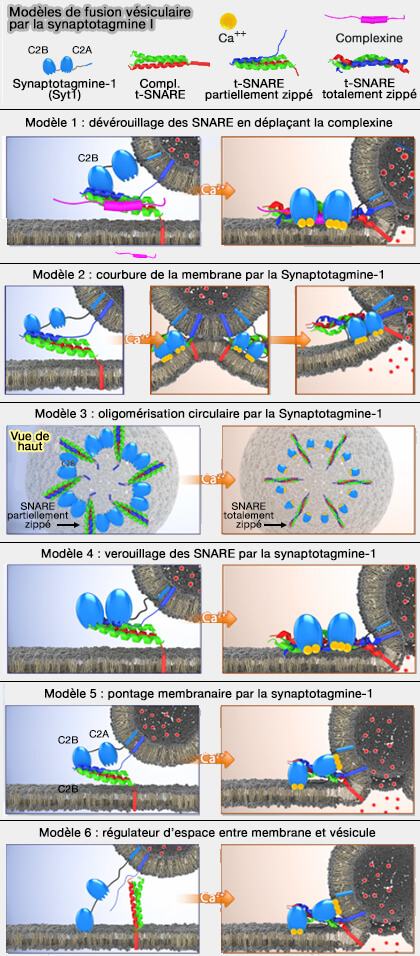
- Modèle 4 : verrouillage des SNARE par Syt1,
- Modèle 5 : pontage membranaire,
- Modèle 6 : régulateur de distance VS/MP.

Les questions principales sont les suivantes :
- Syt1 se lie-elle au complexe SNARE, à la membrane présynaptique ou aux deux, lors de l'arrimage des vésicules dans un environnement ionique physiologique qui comprend ATP/Mg++ (Synaptotagmin-1 C2B domain interacts simultaneously with SNAREs and membranes to promote membrane fusion 2016) ?
- Comment Syt1, avec la complexine (Cplx), contrôle le verrouillage du complexe SNARE pour restreindre la fusion spontanée avant l'augmentation de Ca++ ?
- Si la complexine est un facteur de verrouillage du complexe SNARE, comment la fusion des vésicules s'arrête avant l'augmentation de Ca++ ?
- Comment Syt1 débloque le verrouillage et enclenche la fermeture complète du complexe SNARE pour déclencher la fusion membranaire dépendante de Ca++ ?
Modèles moins probables
Modèle 4 : verrouillage des SNARE par Syt1
1. Les domaines C2A/B de Syt1, et non la complexine (Cplx), se lie au complexe SNARE et le verrouille dans une conformation partiellement zippée (Synaptotagmin arrests the SNARE complex before triggering fast, efficient membrane fusion in response to Ca2+ 2009).
-
Modèle 4 de fusion vésiculaire par Syt1
(Figure : vetopsy.fr d'après Park et Ryu)
2. Syt1 lié au Ca++ libère le verrouilage du complexe SNARE et l'insère dans la membrane plasmique, déclenchant ainsi la fermeture éclair complète du complexe SNARE pour la fusion des vésicules.

Cependant, de nombreuses études contredisent ce modèle (cf. revue).
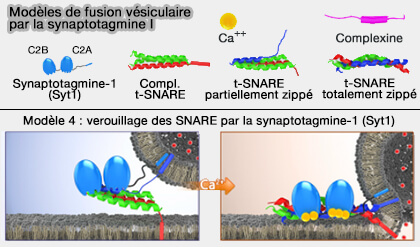
Modèle 5 : pontage membranaire
Le domaine C2B de Syt1 entrerait en contact par ses côtés opposés avec les membranes des vésicules synaptiques (VS) et de la membrane présynaptique (Solution and Membrane-Bound Conformations of the Tandem C2A and C2B Domains of Synaptotagmin 1: Evidence for Bilayer Bridging 2010).
(Figure : vetopsy.fr d'après Park et Ryu)
1. Avant l'arrivée du Ca++, les poches de liaison au Ca++ des domaines C2A et C2B repoussent les membranes, et cette répulsion stabilise le complexe SNARE partiellement zippé et inhibe la fusion membranaire (Close membrane-membrane proximity induced by Ca2+-dependent multivalent binding of synaptotagmin-1 to phospholipids 2006).
2. Avec l'afflux de Ca++, les domaines C2A et C2B se lient aux membranes opposées (Cross-linking of Phospholipid Membranes is a Conserved Property of Calcium-sensitive Synaptotagmins 2008).
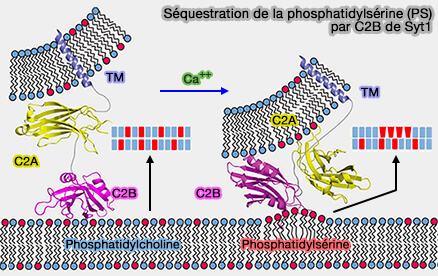
- Le domaine C2A est inséré dans la membrane de la vésicule, mais la patch polybasique du domaine C2B interagit sélectivement avec PI(4,5)P2 ou PIP2 (Solution and Membrane-Bound Conformations of the Tandem C2A and C2B Domains of Synaptotagmin 1: Evidence for Bilayer Bridging 2010).
- Le lien (linker) entre les domaines C2A et C2B est si flexible que les deux domaines C2 relient la membrane opposée à une distance d'environ 4 nm, facilitant ainsi la fusion des vésicules.
(Figure : vetopsy.fr d'après Lai et coll)
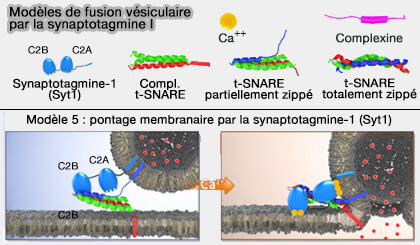
Le pontage membranaire par Syt1 pourrait s'effectuer de deux manières différentes (Prevalent mechanism of membrane bridging by synaptotagmin-1 2013)
- Le modèle d'oligomérisation, dans lequel les domaines C2A et C2B ont des orientations parallèles par rapport à la membrane plasmique, déclencherait la fusion des vésicules.
- Le modèle de pontage direct dans lequel les domaines C2A et C2B ont des orientations antiparallèles par rapport à la membrane plasmique, bloquerait la fusion des vésicules (Different states of synaptotagmin regulate evoked versus spontaneous release 2016).
3. Cependant, l'environnement ionique physiologique qui comprend l'ATP/Mg++ perturbe l'interaction des domaines C2 avec la membrane de la vésicule (Controlling synaptotagmin activity by electrostatic screening 2013 et Ring-like oligomers of Synaptotagmins and related C2 domain proteins 2016).

Le domaine C2 n'est inséré que dans la membrane plasmique contenant PI(4,5)P2 ou PIP2 pour déclencher la fusion des vésicules, et non dans la membrane des vésicules.
Modèle 6 : régulateur de distance VS/MP
1. Ce modèle suggère que les protéines SNARE ne pourraient pas être préassemblées avant l'augmentation de Ca++ et que le domaine C2B de Syt1 entrerait en contact par ses côtés opposés avec les vésicules synaptiques (VS) et la membrane présynaptique (Synaptotagmin-1 may be a distance regulator acting upstream of SNARE nucleation 2011).
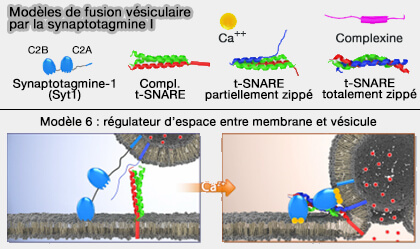
(Figure : vetopsy.fr d'après Park et Ryu)
C'est la principale différence avec le modèle 4.
2. Le patch polybasique du domaine C2B est responsable de la liaison indépendante de Ca++ à PI(4,5)P2 ou PIP2 et est impliquée dans l'amarrage des vésicules (Control of membrane gaps by synaptotagmin-Ca2+ measured with a novel membrane distance ruler 2014).
Les liposomes, avec Syt1 ancrée à la membrane, maintiennent deux membranes éloignées (7–8 nm) l'une de l'autre en l'absence de Ca++ et bloquent ainsi la fermeture éclair SNARE.
Lors de la liaison au Ca++, Syt1 fonctionne rapproche les deux membranes, initiant ainsi la formation du complexe tSNARE et la fusion membranaire, i.e. Syt1 fonctionnerait comme un régulateur de distance.

Cependant, l'amarrage des vésicules synaptiques (VS) à une distance d'environ 8 nm semble peu probable pour deux raisons majeures.
- Les vésicules synaptiques sont étroitement ancrées à 2 nm de la zone active (AZ).
- Munc13 et d'autres protéines régulatrices SNARE pourraient induire un amarrage serré des vésicules in vivo (The Morphological and Molecular Nature of Synaptic Vesicle Priming at Presynaptic Active Zones 2014).
Retour à la fusion membranaire
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


