Cycle cellulaire
Organisation générale de la régulation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

La régulation du cycle cellulaire repose sur un réseau intégré de complexes cycline/CDK, de checkpoints, de contrôles transcriptionnels, post-traductionnels et spatiaux assurant la fidélité de la division.
La régulation du cycle cellulaire repose sur une progression conditionnelle à travers les phases G1, S, G2 et M.
Chaque transition dépend de l’activation coordonnée :
- de régulateurs centraux, complexes cycline/CDK, APC/C, SCF,
- de systèmes de surveillance, p53, ATR/Chk1 et ATM/Chk2, point de contrôle du fuseau (SAC).
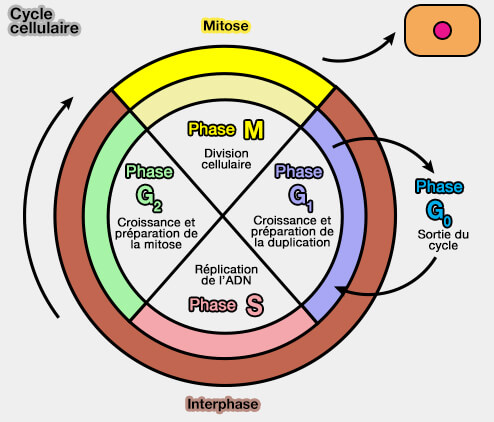
(Figure : vetopsy.fr d'après Zephris)
Le cycle correspond à un système décisionnel séquentiel et non à une simple horloge.
Réseau central de commande
1. Le cœur du système repose sur l’oscillation de l’activité des complexes cycline/CDK.
- Les CDK (CDK1, CDK2, CDK4, CDK6…) sont des kinases sérine/thréonine dont l’activité dépend strictement de leur association à une cycline.
- Les cyclines (cycline D, cycline E, cycline A, cycline B…) sont exprimées et dégradées de manière périodique, ce qui impose la dynamique temporelle du cycle.
Les principaux complexes fonctionnels sont :
- les complexes cycline D/CDK4-6, impliqués dans la progression de G1,
- les complexes cycline E/CDK2 et cycline A/CDK2, associés à la transition G1/S et à la phase S,
- le complexe cycline B/CDK1 (MPF), responsable de l’entrée et de la progression en mitose.
Rôles des cyclines/CDK
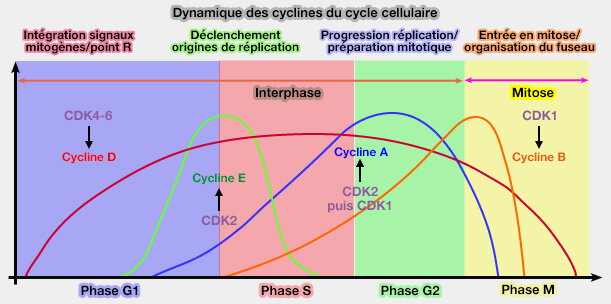
(Figure : vetopsy.fr)
2. L’activité des complexes cycline/CDK est modulée par des régulateurs directs, qui assurent que leur activation ne dépend pas uniquement de la présence des cyclines, mais aussi, de l’état fonctionnel global de la cellule.
- Des activateurs tels que Cdc25 et la CAK (cycline H/CDK7/Mat1) favorisent l’activation des CDK.
- Des inhibiteurs tels que Wee1 et Myt1 (PKMYT1), p21CIP1 et p27KIP1 limitent ou bloquent leur activité selon le contexte cellulaire.
3. La dynamique du système repose également sur des mécanismes de dégradation protéique contrôlée.
Les complexes APC/CCdc20, APC/CCdh1 et SCFSkp2 assurent l’élimination ciblée de nombreuses cyclines et régulateurs, rendant certaines transitions irréversibles.

La progression du cycle repose sur un système de commutation dynamique, fondé sur l’équilibre entre synthèse, activation, inhibition et dégradation des régulateurs, organisé par des boucles de rétrocontrôle assurant la robustesse du système et la cohérence temporelle des transitions.
Trois niveaux complémentaires de régulation
La régulation du cycle s’exerce simultanément à trois niveaux fonctionnels.
Niveau transcriptionnel
Le niveau transcriptionnel détermine si une cellule est apte à entrer et à progresser dans le cycle en contrôlant l’expression des gènes directement impliqués dans la réplication de l’ADN et la division.
1. MYC agit principalement en phase G1 précoce, en amont du point de restriction (R), en favorisant l’entrée en cycle en stimulant l’expression de gènes impliqués dans :
- la croissance cellulaire (ribosomes, biogenèse mitochondriale),
- le métabolisme,
- la progression du cycle (cyclines, CDK, E2F).
2. p53 bloque l’entrée dans le cycle, par le ckeckpoint G1/S principalement, et peut également renforcer le contrôle G2/M en cas de dommages persistants, en induisant l’expression de gènes inhibiteurs tels que p21CIP1, qui freine directement l’activité des complexes cycline/CDK.
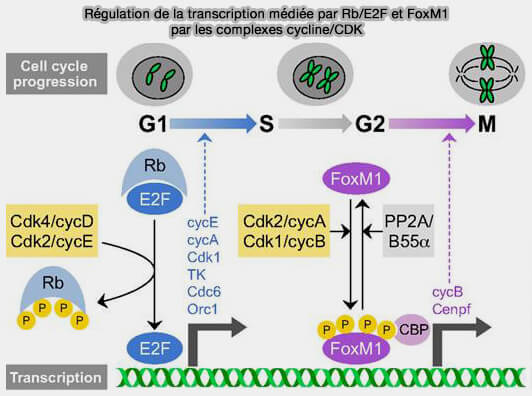
(Figure : vetopsy.fr d'après Lim et Kaldis)
3. Le couple Rb/E2F régule l’expression des gènes de la phase S.
- RB empêche l’expression des gènes de la phase S en inhibant les facteurs E2F.
- E2F active la transcription de gènes indispensables à la réplication de l’ADN, notamment la cycline E, la cycline A, CDK2, des unités du complexe de pré‑réplicatif (pré-RC), i.e. MCM et CDC6, PCNA et les ADN polymérases.
4. FOXM1 active l’expression de nombreux gènes nécessaires à la transition G2/M et à la mitose, notamment la cycline B, Plk1, Aurora A, CENP-A, les protéines du fuseau mitotique et les facteurs de condensation chromosomique.
Niveau post-traductionnel
Le niveau post-traductionnel ajuste en temps réel l’activité des régulateurs du cycle par des modifications chimiques réversibles et par la dégradation ciblée des protéines.
1. La phosphorylation constitue le mode de contrôle principal.
a. CDK1, CDK2, Plk1, Aurora A et Aurora B modulent l’activité de nombreux effecteurs impliqués dans :
- la condensation chromosomique par les condensines,
- l’organisation du fuseau (centrosome, microtubules),
- la dynamique du kinétochore,
- la progression des transitions majeures du cycle.
b. Les activateurs et inhibiteurs des CDK assurent un contrôle direct et fin de ces transitions.
- Wee1 et Myt1 (PKMYT1) inhibent les CDK par phosphorylation, ce qui empêche l’entrée prématurée en mitose. Cdc25 active les CDK en retirant ces phosphorylations inhibitrices, autorisant les transitions G2/M et G1/S.
2. L’ubiquitination permet un contrôle irréversible par dégradation protéasomale.
- APC/CCdc20 déclenche la transition métaphase-anaphase en ciblant notamment la sécurine et la cycline B.
- APC/CCdh1 maintient l’état post-mitotique en éliminant de nombreux régulateurs mitotiques.
- SCFSkp2 favorise la transition G1/S en ciblant des CKI (CDK inhibitors) , comme p27KIP1.
Niveau spatial
Le niveau spatial conditionne l’activité des régulateurs du cycle par leur localisation subcellulaire, ce qui permet de restreindre certaines fonctions à des compartiments précis.
- Le complexe cycline B/CDK1 (MPF) doit s’accumuler dans le noyau pour déclencher l’entrée en mitose.
- Plk1 et Aurora A exercent leurs fonctions principalement au centrosome et sur le fuseau.
- Aurora B agit au kinétochore et au plan équatorial via le complexe CPC (Chromosomal Passenger Complex).
- Les protéines du point de contrôle du fuseau (SAC), Mad1, Mad2, Bub1, BubR1, MPS1, ne sont actives que lorsqu’elles sont recrutées aux kinétochores non attachés.
La compartimentation nucléaire, centrosomale, chromosomique et corticale constitue ainsi un niveau de régulation à part entière du cycle.
Checkpoints et validation des transitions
Les points de contrôle (checkpoints) sont des systèmes de surveillance qui empêchent la progression du cycle tant que certaines conditions biologiques essentielles ne sont pas remplies.
1. La progression du cycle cellulaire est d’abord encadrée par des checkpoints majeurs qui valident les transitions critiques.
a. Le checkpoint G1/S contrôle l’intégrité de l’ADN avant l’engagement dans la réplication et conditionne l’entrée en phase S.
Il repose principalement sur l’axe ATM/Chk2 (et secondairement sur ATR/Chk) ➞ p53 ➞ p21CIP1, qui bloque l’activité des complexes cycline/CDK en cas de dommage.
b. Le checkpoint G1/S surveille la progression des fourches de réplication et empêche la poursuite du cycle en cas de stress de réplication ou d’anomalie de l’ADN.
- Il repose principalement sur l’axe ATR/Chk1 qui ajuste l’activité des CDK afin de stabiliser les fourches, de coordonner la réparation et d’éviter toute entrée prématurée en G2/M.
- Ce checkpoint constitue un dispositif de surveillance dynamique actif tout au long de la phase S.
Remarque : le contrôle de la réplication (replication licensing control) empêche toute re-réplication de l’ADN au cours d’un même cycle.
- Il repose sur le complexe de pré‑réplicatif (pré-RC), Cdt1, Cdc6, ORC, MCM, géminine et l’activité des CDK, qui rendent les origines réfractaires à tout rechargement après leur activation en phase S.
- Ce mécanisme ne correspond pas à un checkpoint de surveillance, mais à un verrou structurel garantissant l’unicité de la duplication du génome.
c. Le checkpoint G2/M empêche l’entrée en mitose si la réplication est incomplète ou si l’ADN est altéré.
Il implique ATR/Chk1 et ATM/Chk2, Wee1 et Myt1 (PKMYT1) et Cdc25, qui convergent vers le contrôle de l’activation du complexe cycline B/CDK1 (MPF).
d. Le contrôle mitotique dépend du point de contrôle du fuseau (SAC ou Spindle Assembly Checkpoint), qui vérifie l’attachement correct des chromosomes (attachements end-on stables) au fuseau et bloque la progression tant que la biorientation n’est pas assurée.
Il repose sur Mad1, Mad2, Bub1, BubR1, MPS1 et le MCC (Mitotic Checkpoint Complex), qui inhibe l’APC/C tant que tous les kinétochores ne sont pas correctement attachés.
2. En complément de ces checkpoints classiques, d’autres dispositifs de contrôle participent à l’organisation globale du cycle cellulaire.
a. En G0 et en G1, le contrôle épigénétique module durablement la compétence proliférative par l’état de la chromatine.
Polycomb, remodelage de la chromatine, méthylation de l’ADN et modifications des histones modulent l’accessibilité des gènes impliqués dans le cycle.
b. Le contrôle par la quiescence (G0), en amont de G1, correspond à un état cellulaire stable et réversible, dans lequel la cellule se maintient volontairement hors du cycle, indépendamment de tout dommage, mais en réponse à des signaux physiologiques.
p27KIP1, Rb, E2F, FOXO et les voies TGF-β et Hippo contribuent au maintien en quiescence ou au retour en prolifération selon le contexte.
c. Le contrôle mécanique et environnemental s’exerce principalement en G1 précoce, en amont du point de restriction, et intègre l’adhérence cellulaire, la densité et les propriétés du micro-environnement.
Ces signaux sont intégrés via YAP/TAZ (voie Hippo), les intégrines et le cytosquelette d’actine.
d. Le point de restriction (R) ou contrôle de la croissance cellulaire et de l’état métabolique, en fin de G1, conditionne l’entrée en cycle selon le contexte physiologique.
mTOR, AMPK et MYC relient la disponibilité énergétique et nutritive à l’expression des cyclines et à l’activité des CDK.
Couplage avec les signaux extracellulaires
La régulation du cycle est étroitement couplée aux voies de signalisation et s’intègre à l’état physiologique global de la cellule.
1. De nombreux signaux extracellulaires régulent l’expression et l’activité des complexes cycline/CDK ainsi que de leurs inhibiteurs, adaptant la progression du cycle à l’état physiologique de la cellule.
- MAPK/ERK (Ras-Raf-MEK-ERK) stimule l’expression des cyclines de G1 (cycline D, cycline E) et favorise l’entrée en cycle en réponse aux facteurs de croissance.
- voie PI3K/Akt couple la disponibilité énergétique et nutritive à la progression du cycle en stimulant la synthèse protéique, la croissance cellulaire et l’expression des cyclines.
- TGF-β exerce principalement un contrôle antiprolifératif en induisant des inhibiteurs de CDK (p15, p21, p27) et en réprimant l’expression des cyclines de G1.
- Wnt/β-caténine favorise l’entrée en cycle en activant l’expression de gènes pro-prolifératifs tels que MYC et cycline D1.
- Hippo (YAP/TAZ) module la prolifération en fonction du contexte mécanique et de la densité cellulaire.
2. Le cycle cellulaire n’est donc pas un programme autonome, mais un module régulé en permanence par l’environnement physiologique de la cellule.
Retour au cycle cellulaire
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


