Protéines
Modifications post-traductionnelles
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Une modification post-traductionnelle (PTM) est la modification chimique covalente d'une protéine, réalisée le plus souvent par une enzyme, pendant ou après sa synthèse.
Vue d'ensemble des modifications post-traductionnelles
1. La synthèse des protéines est effectuée par les ribosomes qui traduisent l'ARNm pour fabriquer des chaînes polypeptidiques. Ces protéines peuvent subir une transformation pour construire la protéine dite mature :
- une modification post-traductionnelle, après le relargage par les ribosomes,
-
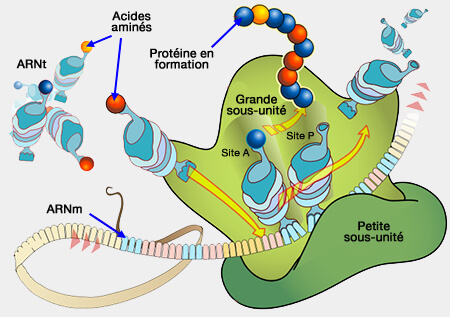
Translation dans le ribosome
Ces modifications des protéines ont pour rôle :
- la régulation de leur activité,
- leur reconnaissance par d'autres molécules ou par les systèmes de dégradation,
- leur ancrage sur une membrane,
- leur implication dans les voies de signalisation,
- leur ciblage vers un compartiment cellulaire.

La PTM est essentielle, en particulier dans les voies de signalisation cellulaire.
2. La PTM peut s'effectuer de différentes manières :
- addition d'un groupe fonctionnel,
- addition de groupes peptidiques ou de protéines,
- modification chimique des acides aminés,
- changements structuraux.

Nous ne citerons que les principales PTM et vous pouvez lire : Post-translational modification de Wikipedia.
Addition d'un groupe fonctionnel
Addition par une enzyme
Groupes hydrophobes pour la localisation membranaire
Les protéines sont modifiées par des lipides et nous n'énumérerons que les plus courantes.
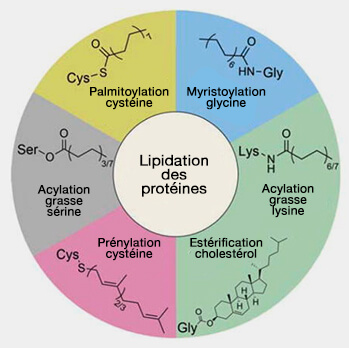
(Figure : vetopsy.fr d'après Jiang et coll)
Isoprénylation
L'isoprénylation, appelée aussi prénylation, est la liaison d'un groupe isoprénoïde, appelée aussi terpénoïde (farnésol et géranylgéraniol).
1. Elle comprend :
- la farnésylation,
- la géranylgéranylation,
- la myristoylation (ou myristillation), liaison du myristate (acide myristique ou tétradécanoïque, acide saturé en C14).
2. L'isoprénylation et la N-myristoylation sont des modifications co-traductionnelles ou immédiatement post-traductionnelles, i.e. le groupement attaché le reste jusqu'à la dégradation de la protéine.
Palmitoylation
La palmitoylation ajoute dans la majorité des cas l'acide palmitique ou hexadécanoïque, acide saturé en C16 (What, when, how et Protein palmitoylation and subcellular trafficking 2011).
1. La S-palmitoylation (ou S-acylation ou thioacylation) est une modification post-traductionnelle qui ajoute un acide gras sur une ou plusieurs cystéines d'une protéine membranaire, via une liaison thioester ($\ce{R-S-CO-R'$}), liaison " riche en énergie " (What does S-palmitoylation do to membrane proteins? 2013).
a. Les acides gras thioesterifiés aux protéines comprennent des acides gras autres que l'acide palmitique, saturés ou non, de différentes longueurs (C14 ou plus).
La sérine et la thréonine peuvent aussi, mais plus rarement, être palmitoylées, comme dans la signalisation Wnt, et ce, par d'autres acides gras comme l'acide palmitoléique (acide gras monoinsaturé ou MUFA en C16).
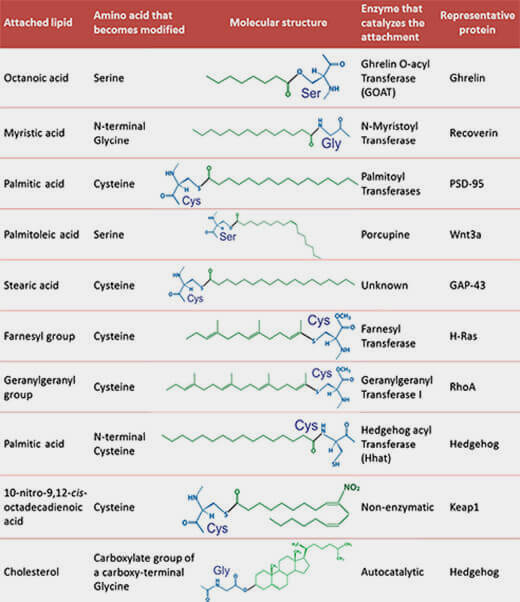
(Figure : Clara Aicart-Ramos)
b. La palmitoylation des protéines membranaires peut, de manière non exclusive :
- modifier la conformation de leur domaine transmembranaire, i.e. modification de l'angle avec la membrane,
- réguler leur association, positivement ou négativement, avec les radeaux lipidiques,
- favoriser la formation de complexes protéiques,
- inhiber l'ubiquitination des lysines à proximité du site de la palmitoylation.
Par exemple, l'inclinaison du domaine transmembranaire peut promouvoir, ou son association avec un domaine spécifique qui le séquestre pour qu'il ne soit pas proche de son E3-ubiquitine ligase, ou son association avec des protéines présentes dans ce domaine (What does S-palmitoylation do to membrane proteins? 2013).
2. La N-palmitoylation attache un palmitate par l'intermédiaire d'une liaison amide.
- Cette modification a été décrite sur un résidu cystéine de l'extrémité N-terminale de Sonic Hedgehog (Shh), une protéine de signalisation (Identification of a Palmitic Acid-modified Form of Human Sonic hedgehog 1998).
- Elle peut survenir aussi au niveau du groupe ε-amine de la lysine avec le myristate ou le palmitate par une liaison amide.
3. La palmitoylation est post-traductionnelle, réversible et bien plus rapide que la dégradation des protéines, d'où son rôle dans les voies de signalisation, en particulier Wnt, où la régulation est essentielle.
Remarque : N-myristoylation, N-palmitoylation, S-palmitoylation et O-acylation, i.e. liaison d'acides gras par une liaison oxyester sur un résidu lysine ou thréonine, ce qui est plus rare, peuvent être classées aussi dans les acylations (Palmitoylation of Intracellular Signaling Proteins: Regulation and Function 2004).
Glypation
La glypiation est la formation d'une ancre glycosylphosphatidylinositol (GPI) par un pont amide à l'extrémité C-terminale de la protéine (Glycosylphosphatidylinositol Anchors 2009).
La glypiation est co- et post-traductionnelle.
Cofacteurs pour améliorer l'activité enzymatique
Des cofacteurs peuvent être ajoutés pour améliorer l'activité enzymatique.
- Lipoylation, liaison d'un lipoate (acide lipoïque en C8),
- Fragment de flavine (FMN ou FAD),
- Liaison de l'hème C, par des ponts thioéther avec des cystéines,
- phosphopantéthéinylation, addition d'un fragment de 4'-phosphopantéthéinyl à partir du coenzyme A,
- Formation d'une base de Schiff (à partir du rétinal).
Groupes chimiques
D'autres groupes chimiques que les groupes hydrophobes peuvent être ajoutés par l'activité enzymatique.
1. Acylation, O-acylation (esters), N-acylation (amides), S-acylation (thioesters) :
- Acétylation, addition d'un groupe acétyl (OCH3) par l'acétyl-CoA, soit à l'extrémité N-terminale d'une protéine ou sur des résidus lysine (le processus inverse est appelé déacétylation),
- Formylation.
2. Alkylation, addition d'un groupe alkyle (méthyle, éthyle…) :
Méthylation, i.e. addition d'un groupe méthylé, en général sur les résidus lysine ou arginine (le processus inverse est appelé déméthylation).
3. Formation de liaison amide :
- Amidation à l'extrémité C-terminale,
- Addition d'acides aminés :
- Polyglutamylation, lien covalent de résidus d'acide glutamique à l'extrémité N-terminale de la tubuline et de quelques autres protéines,
- Polyglycylation, lien covalent de résidus glycine (de 1 à plus de 40) à l'extrémité C-terminale de la tubuline.
4. Glycosylation, addition d'un groupe glycosyl à l'arginine, à l'asparagine, à la cystéine, à l'hydroxylysine, à la sérine, à la thréonine, à la tyrosine et au tryptophane pour fabriquer une glycoprotéine.
Ce processus est différent de la glycation, qui est une liaison non enzymatique avec un glucide :
- N-glycosylation, essentielle pour le repliement de certaines protéines et les adhérences entre cellules ou entre cellule et matrice extra-cellulaire,
- O-glycosylation,
- Polysialylation, addition de l'acide polysialique (PSA) à NCAM (Neural cell adhesion molecule).
5. Hydroxylation, addition d'un groupe hydroxyle (-OH) à une protéine, le plus souvent sur un résidu proline ou lysine formant l'hydroxyproline ou l'hydroxylysine.
6. Oxydation
7. Formation d'un organophosphate (ester phosphate O-linked) ou phosphoramidate (N-linked) :
- Phosphorylation, addition d'un groupe phosphate, le plus souvent sur la sérine, la thréonine et la tyrosine (O-linked), ou l'histidine (N-linked) par les kinases (le processus inverse est appelé déphosphorylation effectuée par les phosphatases),
- Adénylylation (adénylation ou AMPylation), addition d'un fragment adénylyl (AMP), le plus souvent sur la tyrosine (O-linked), l'histidine ou la lysine (N-linked).
8. Succinylation, addition d'un groupe succinyl à la lysine.
9. Sulfatation (sulfation en anglais), transfert d'un sulfate ($\ce{-SO3}$) ou un groupe de sulfates à un accepteur via une sulfotransférase, (EC 2.8.2.-) utilisant le PAPS (3′-phospho-adénosine-5′-phosphosulfate), comme donneur de sulfate,
10. ADP-ribosylation, addition de nombreux ADP-ribose sur les substrats protéiques.
Addition non enzymatique
Glycation, addition d'un glucide à une protéine sans l'action d'une enzyme.
Autres protéines ou peptides
1. Ubiquitination, formation d'une liaison covalente avec l'ubiquitine.
2. SUMOylation, formation d'une liaison covalente avec les protéines SUMO (Small Ubiquitin-related MOdifier).
3. Neddylation, formation d'une liaison covalente avec les protéines NEDD8 en suivant un mécanisme très semblable à celui de l'ubiquitination.
4. ISGylation, formation d'une liaison covalente de la protéine ISG15 (Interferon-Stimulated Gene 15) aux protéines membranaires et cytoplasmiques.
Modifications structurelles
1. Ponts disulfure (disulfide bond), liaison covalente entre deux cystéines.
2. Clivage protéolytique, clivage par une protéase d'une liaison peptidique.
3. Racémisation, i.e. conversion d'une solution contenant un seul énantiomère en une solution où les deux sont présents.


