Fusion vésiculaire : protéines SNARE
Régulation des protéines SNARE
Modèles de régulation par les synaptotagmines et la complexine (3)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Les protéines des familles synaptotagmine et complexine constituent une classe de régulateurs des protéines SNARE qui sont particulièrement importants dans les événements de fusion déclenchés par le calcium.
(Figure : vetopsy.fr d'après Park et Ryu)
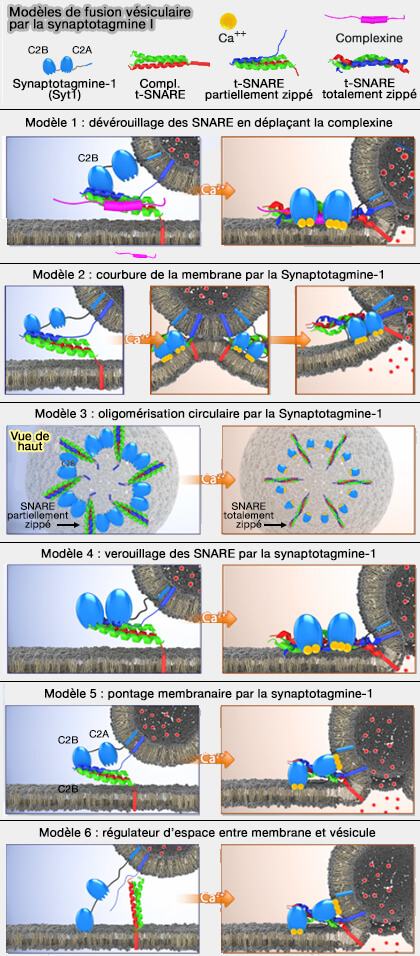
Différents modèles controversés, mais qui peuvent se chevaucher partiellement, ont été formulés pour expliquer comment la synaptotagmine-1 (Syt1) et la complexine (Cplx) couple la liaison Ca++ à la fusion membranaire (Models of synaptotagmin-1 to trigger Ca2+-dependent vesicle fusion 2018).
Certains modèles sont probables et ne s'excluant pas forcément :
- Modèle 1 : déverrouillage des SNARE par Syt1 en déplaçant Cplx,
- Modèle 2 : courbure de la membrane par Syt1,
- Modèle 3 : oligomérisation circulaire.
D'autres modèles sont moins probables :
- Modèle 4 : verrouillage des SNARE par Syt1,
- Modèle 5 : pontage membranaire,
- Modèle 6 : régulateur de distance VS/MP.

Les questions principales sont les suivantes :
- Syt1 se lie-elle au complexe SNARE, à la membrane présynaptique ou aux deux, lors de l'arrimage des vésicules dans un environnement ionique physiologique qui comprend ATP/Mg++ (Synaptotagmin-1 C2B domain interacts simultaneously with SNAREs and membranes to promote membrane fusion 2016) ?
- Comment Syt1, avec la complexine (Cplx), contrôle le verrouillage du complexe SNARE pour restreindre la fusion spontanée avant l'augmentation de Ca++ ?
- Si la complexine est un facteur de verrouillage du complexe SNARE, comment la fusion des vésicules s'arrête avant l'augmentation de Ca++ ?
- Comment Syt1 débloque le verrouillage et enclenche la fermeture complète du complexe SNARE pour déclencher la fusion membranaire dépendante de Ca++ ?
Modèles probables ne s'excluant pas
Les deux premiers modèles sont étudiés dans le chapitre précédent :
- Modèle 1 : déverrouillage des SNARE par Syt1 en déplaçant Cplx,
- Modèle 2 : courbure de la membrane par Syt1.
(Figure : vetopsy.fr d'après Rothman et coll)
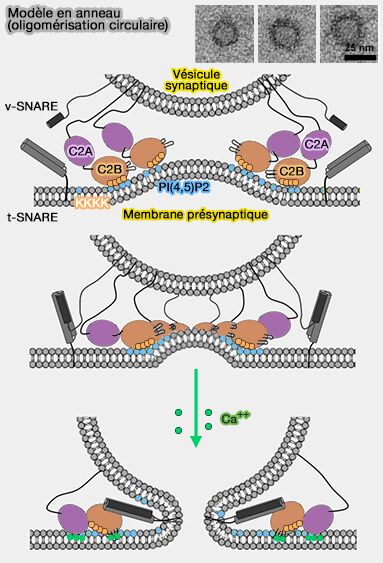
Modèle 3 : oligomérisation circulaire
Ce modèle tente d'expliquer les études structurales et les oligomères Syt1 en forme d'anneaux planaires qui sont observés en utilisant la microscopie électronique (Circular oligomerization is an intrinsic property of synaptotagmin 2017 et Hypothesis – buttressed rings assemble, clamp, and release SNAREpins for synaptic transmission 2017).
Oligomérisation circulaire
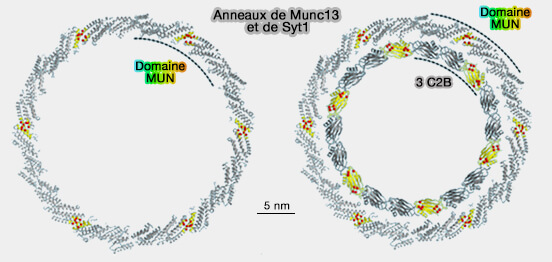
1. Une oligomérisation circulaire de Syt1 se formerait sur la membrane plasmique par les domaines C2B et bloquerait ainsi la fermeture éclair SNARE complète, i.e. complexe cis-SNARE , et la fusion des vésicules (Ring-like oligomers of Synaptotagmins and related C2 domain proteins 2016).
2. Cet anneau de Syt1, composé de 18 copies et mesurant 20 à 35 nm de diamètre, pourrait être renforcé par les domaines MUN de Munc13 qui formeraient un anneau concentrique.
a. Munc13 alignerait la poche hydrophobe du milieu du domaine MUN avec l'interface principale de trois C2B de Syt1 (Calcium sensitive ring-like oligomers formed by synaptotagmin 2014).
(Figure : vetopsy.fr d'après Rothman et coll)
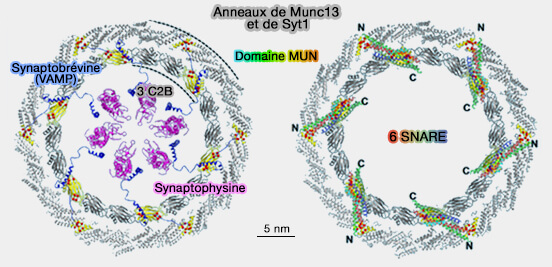
b. Les synaptobrévine 2/VAMP2 seraient pré-organisés au sein des vésicules synaptiques (VS) en unités hexamériques par les interactions de son domaine transmembranaire avec celui de la synaptophysine, une protéine membranaire (Architecture of the Synaptophysin/Synaptobrevin Complex: Structural Evidence for an Entropic Clustering Function at the Synapse 2015).
- Lorsque la vésicule synaptique s'approche due la membrane plasmique, les synaptobrévine 2/VAMP2 disposées de manière hexagonale par la synaptophysine sont convenablement positionnés pour atteindre la surface active de chaque sous-unité MUN pour modéliser l'assemblage SNARE.
- Un total de six complexes SNARE couvrent les anneaux externe et interne avec leurs domaines transmembranaires C-terminaux au-dessus des VS et en dessous de la membrane plasmique.
(Figure : vetopsy.fr d'après Rothman et coll)
Assemblage et verrouillage des SNARE
Cette structure annulaire symétrique hexamérique d'environ 4 nm de hauteur permettrait l'assemblage partiel du complexe SNARE, mais inhiberait la fermeture complète, i.e. bloquerait la fusion (Hypothesis - buttressed rings assemble, clamp, and release SNAREpins for synaptic transmission 2017).
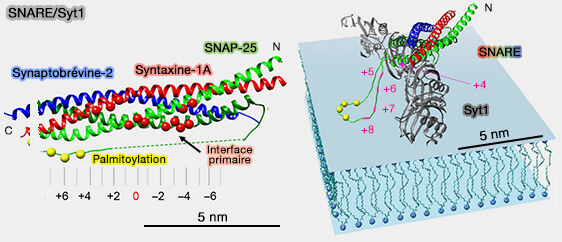
(Figure : vetopsy.fr d'après Rothman et coll)
1. Les SNARE doivent être zippées jusqu'à ou au-delà de la couche +3 pour s'adapter à la liaison de Syt1.
- Le positionnement du complexe SNARE au sommet de l'anneau Syt implique que les résidus de l'hélice SN1 (N-terminale) de SNAP-25 qui s'assemblent avec les couches +5 à +8 pour finir de zipper le complexe et de déclencher la fusion devraient plutôt être presque entièrement étendus dans cette géométrie pour permettre aux sites de palmitoylation des cystéines adjacents d'être insérés dans la bicouche de la membrane plasmique.
- La fermeture éclair au-delà de la couche +4 serait entravée en raison de la séparation spatiale entre les membranes imposée par l'anneau.
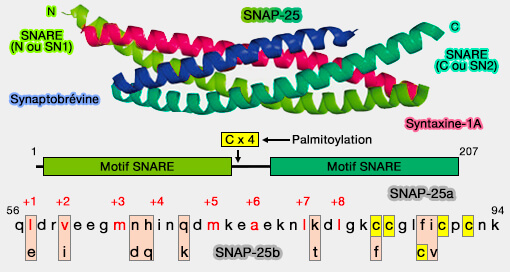
(Figure : vetopsy.fr d'après Nagy et coll)
2. Les SNARE sur l'anneau Syt1 forment un angle contraint tel que même si elles fermaient complètement leurs quatre faisceaux d'hélices à la couche +8, les pointes de ces faisceaux seraient positionnées à l'intérieur de l'anneau trop loin radialement (17 nm de la pointe +8 à la pointe +8) du centre pour permettre la fusion.

L'anneau Syt1 inhibe aussi radialement la fermeture éclair complète du complexe SNARE.
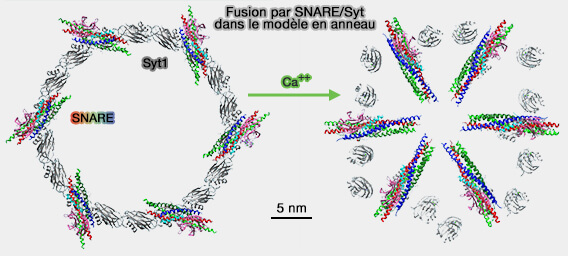
(Figure : vetopsy.fr d'après Rothman et coll)
Déverrouillage des SNARE et fusion
(Figure : vetopsy.fr d'après Zanetti et coll)
1. Lors de la liaison au Ca++, les boucles qui se localisent à l'interface oligomérique, pivotent pour s'insérer dans la membrane et :
- libèrent les complexe SNARE pour enclencher leur fermeture complète,
- les déplacent radialement pour ouvrir le pore de fusion initial.
- dissocient l'anneau oligomère de Syt1,

Les oligomères du cycle Syt1 synchroniseront la libération des neurotransmetteurs par l'influx d'ions calcium.
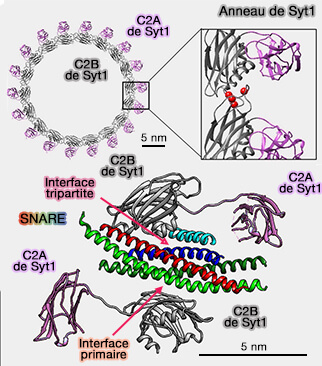
2. L'oligomérisation circulaire de Syt1 pourrait être cohérente avec la structure cristalline du complexe 2 Syt1 pour 1 complexe SNARE décrite en détail (
- Un domaine C2B coordonne le site primaire (indépendant de la complexine).
- Un autre domaine C2B coordonne le site tripartite, i.e. SNARE-Cplx-Syt1.

Actuellement, aucune preuve directe n'a montré d'oligomérisation circulaire de Syt1 in vivo au niveau de la zone active (AZ). Néanmoins, ce modèle pourrait décrire la localisation géométrique entre SNARE/Syt1 et le pore de fusion.
Autres modèles moins probables
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


