Système endo-lysosomal
Complexe ESCRT
ESCRT-III (protéines CHMP)
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

ESCRT-III, composé de protéines CHMP, est considéré comme le principal moteur du remodelage et de la fission membranaire.
Le complexe ESCRT (Endosomal Sorting Complex Required for Transport ou complexe de tri endosomal requis pour le transport) est composé de 5 complexes :
- ESCRT-0,
- ESCRT-I,
- ESCRT-II,
- ESCRT-III,
- Vps4 (Vacuolar Protein Sorting 4) qui contient un domaine catalytique AAA+ ATPase.
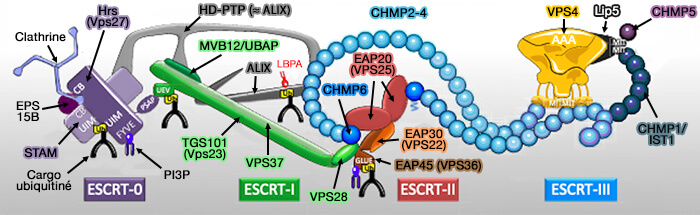
(Figure : vetopsy.fr d'après Christ et Hill)
Vue d'ensemble de ESCRT-III
1. ESCRT-III est considéré comme le principal moteur du remodelage et de la fission membranaire dans le système endo-lysosomal.
- il existe sous forme de monomères solubles en solution.
- Lorsqu'il est activé par ESCRT-I/II ou ALIX, ESCRT-III se polymérise sous forme de filaments spiralés de morphologie, de composition et de stoechiométrie variables, qui déforment la membrane vers l’intérieur de la lumière de l’endosome, et permet ainsi la formation des vésicules intraluminales (ILV) et des endosomes ou corps multivésiculaires (MVE/MVB).
2. ESCRT-IIII est impliqué dans :
- la biogenèse des vésicules intraluminales (ILV) et des endosomes ou corps multivésiculaires (MVE/MVB),
- la cytokinèse,
- le bourgeonnement viral.
3. En général, le complexe ESCRT-III est composé de quatre protéines CHMP différentes :
- CHMP2A/B, Vps2,
- CHMP3, Vps24,
- CHMP4A/B/C, Snf7
- CHMP6, Vps20.
Structure : protéines CHMP
Vue d'ensemble
Les protéines CHMP (CHarged Multivesicular body Protein ou CHromatin Modifying Proteins), hautement conservées par l'évolution, forment une famille qui comprend plusieurs membres, i.e. le premier terme est relatif à l'homme (12 sous-unités en comptant les homologues), le deuxième à la levure (8 sous-unités) :
- CHMP1A/B chez l'homme, Did2 chez la levure,
- CHMP2A/B, Vps2,
- CHMP3, Vps24 (Structural Basis for Budding by the ESCRT-III Factor CHMP3 2006),
- CHMP4A/B/C, Snf7,
- CHMP5, Vps60,
- CHMP6, Vps20,
- CHMP7, Chm7,
- IST1 (Increased Sodium Tolerance-1).
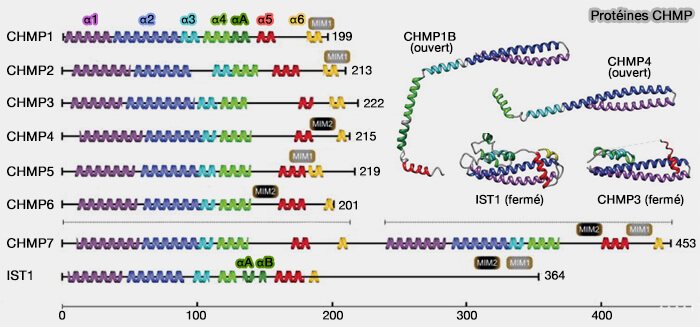
(Figure : vetopsy.fr d'après Schöneberg et coll)
Structure des CHMP
Les CHMP sont formées, en général, par 6 hélices α.
- Les hélices α1-α4, formant le coeur de la protéine, sont les principaux composants structurels des filaments ESCRT, i.e. l'hélice α4 étant très flexible.
- L'hélice α5 joue un rôle régulateur.
1. Les hélices α1-α2 N-terminales, composées d'une centaine de résidus, dessinent une épingle à cheveux rigide et basique (chargées positivement) qui entre en contact avec la membrane endosomale pour la courber.
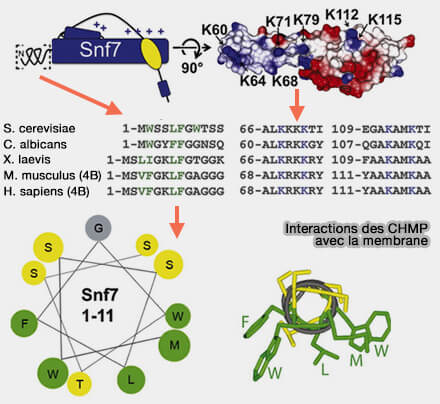
(Figure : vetopsy.fr d'après Mierzva et coll)
Cette interface est réalisée grâce à (Essential N-Terminal Insertion Motif Anchors the ESCRT-III Filament during MVB Vesicle Formation 2013) :
- de nombreux résidus arginine et lysine de α1,
- une extrémité N-terminale amphipathique.
Remarque : dans CHMP6/Vps20, l'interaction avec la membrane est principalement due à sa myristoylation (Human CHMP6, a myristoylated ESCRT-III protein, interacts directly with an ESCRT-II component EAP20 and regulates endosomal cargo sorting 2005).
2. Les quatre hélices plus courtes (α3–α6) sont acides (chargées négativement).
3. Un domaine MIM (Mit Interaction Motif) est généralement présent, parfois 2 comme dans CHMP7 ou parfois aucun comme CHMP3.
Conformations des CHMP
Les CHMP peuvent être sous deux conformations différentes (Structure/Function Analysis of Four Core ESCRT-III Proteins Reveals Common Regulatory Role for Extreme C-Terminal Domain 2007 et Structural basis for activation, assembly and membrane binding of ESCRT-III Snf7 filaments 2015).
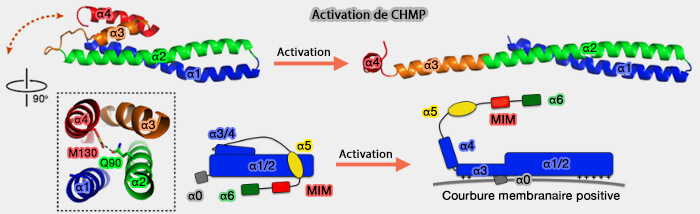
(Figure : vetopsy.fr d'après Tang et coll)
1. Dans la conformation fermée, les hélices α3 et α4 sont repliées sur α1-α2 et α5 est repliée sur α1-α4.
2. Dans la conformation ouverte, les hélices α2 et α3 de CHMP4 sont fusionnées en une seule hélice, prolongeant l'épingle α1-α2, permettant ainsi la polymérisation.
- α4, très flexible, s'allonge par l'addition de régions auparavant non structurées.
- α5 se détache et s'éloigne de α1-α4.
Remarque : la structure polymère IST1-CHMP1B montre que IST1, en position fermée, forme l'extérieur du tube et CHMP1B en position très ouverte, l'extérieur (Structure and membrane remodeling activity of ESCRT-III helical polymers 2015).
Assemblage des ESCRT-III
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


