Domaines protéiques
Domaine PTB (PhosphoTyrosine Binding domain)

Le domaine PTB (PhosphoTyrosine Binding domain) est un domaine protéique qui se lie, le plus souvent, à la phosphotyrosine (pY), comme le domaine SH2.
Structure du domaine PTB
Les domaines PTB comprennent généralement 100 à 170 résidus.
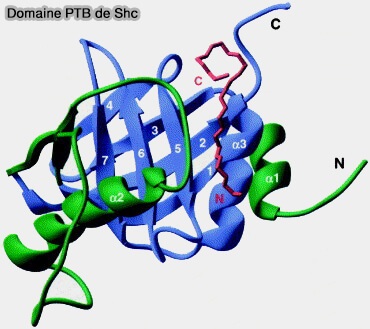
(Figure : vetopsy.fr d'après Yan et coll)
1. Le cœur du domaine est constitué de :
- sept brins β antiparallèles formant deux feuillets β (β sheet) orthogonaux, une hélice α1 s'interposant entre β1 et β2,
- une hélice α qui coiffe à l'extrémité C-terminale.

La structure du domaine PTB est décrite dans : Structure of the PTB domain of tensin1 and a model for its recruitment to fibrillar adhesions (2007) et Understanding the molecular basis of substrate binding specificity of PTB domains (2016).
2. La famille de domaines PTB peut être divisée en trois sous-groupes (Structural and Evolutionary Division of Phosphotyrosine Binding (PTB) Domains 2004).
- les domaines PTB IRS-like,
- les domaines PTB Shc-like,
- les domaines PTB Dab-like.
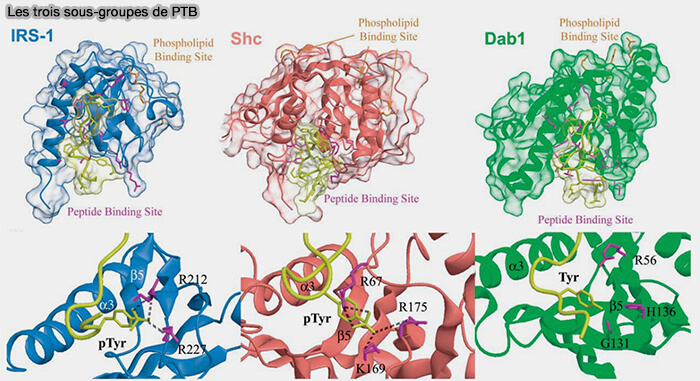
(Figure : vetopsy.fr d'après Uhlik et coll)
3. Le domaine PTB se lie essentiellement aux peptides contenant de la phosphotyrosine (pY) ayant le motif de séquence NPXpY/NXXpY qui adopte un virage bêta fournissant un point d'ancrage pour la liaison.
-
Certains domaines PTB peuvent également reconnaître des peptides à tyrosine non phosphorylée comme, par exemple, dans de nombreux adaptateurs, X11, Dab, Fe65 et Numb (PTB or not PTB – that is the question 2002).
- De plus, le domaine Numb PTB peut se lier à un peptide non apparenté.
a. Toutefois, non seulement le motif NPxY, asparagine-proline-X-tyrosine, mais aussi les résidus qui flanquent ce motif sont des déterminants cruciaux de la spécificité des domaines PTB vis-à-vis de leurs substrats (Signals for sorting of transmembrane proteins to endosomes and lysosomes 2003).
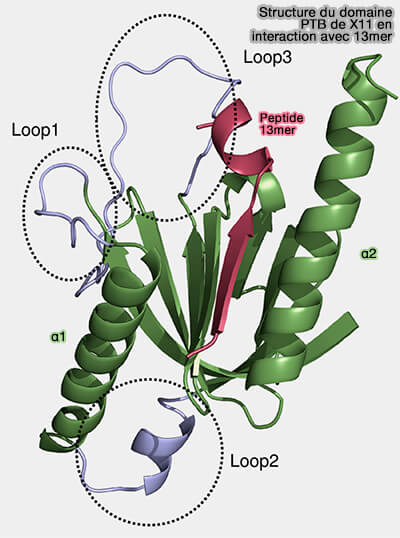
(Figure : vetopsy.fr d'après Sain et coll)
Les peptides contenant des motifs NPXY ou NPXpY identiques se lient avec une spécificité différentielle à différents domaines PTB.
b. Trois régions de boucle flexible deviennent plus ordonnées lors de la liaison peptidique et la flexibilité de la boucle joue un rôle important dans la formation d’un site de liaison peptidique approprié.
Cependant, les domaines PTB adoptent un pli structurel conservé et les peptides de substrat se lient au même site dans une conformation et une orientation similaires.
Rôles des
domaines PTB
1. Le domaine PTB module un large éventail de processus physiologiques :
- le développement neuronal,
- les réponses immunitaires,
- l'homéostasie tissulaire,
- la croissance cellulaire.
2. Les domaines PTB sont présents dans :
- les protéines d’amarrage Shc, impliquée dans l'apoptose, et IRS-1 (Insulin receptor substrate 1),
- la tensine,
- APPL1 qui interagit avec de nombreux récepteurs et protéines de signalisation,
- le sous-domaine F3 du domaine FERM, comme dans la taline, la kindline…
- les LDLR (Low-Density Lipoprotein Receptor) qui interagissent, par exemple, avec ARH pour la régulation du cholestérol,
- la queue intracytoplasmique de la sous-unité β des intégrines…
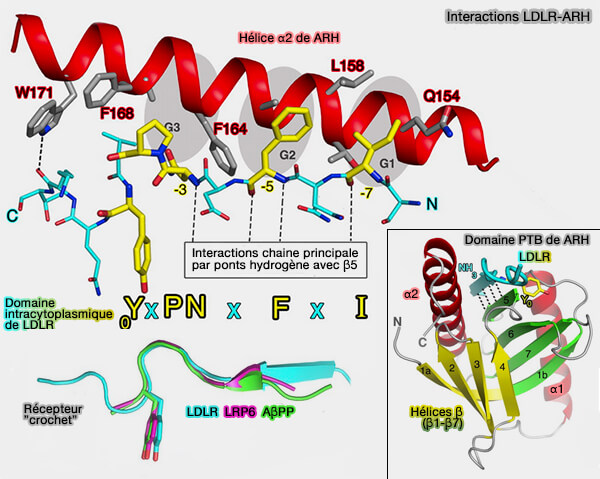
(Figure : vetopsy.fr d'après Dvir et coll)
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


