Transport des lipides : lipoprotéines
Apolipoprotéines
ApoC-II
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'apolipoprotéine C2 (apoC-II), de la famille des apoC, est un cofacteur de la LPL (LipoProtéine Lipase).
L'apoC-II est codée par le groupe de gènes APOE/C1/C4/C2.

Vous pouvez lire : Apolipoprotein C-II: New findings related to genetics, biochemistry, and role in triglyceride metabolism (2017).
L'apolipoprotéine C-II (apoC-II) est une une apolipoprotéine échangeable qui est localisée à la surface des :
- TRL (lipoprotéines riches en triglycérides), i.e. chylomicrons et lipoprotéines de très basse densité (VLDL),
- des HDL (lipoprotéines de haute densité).

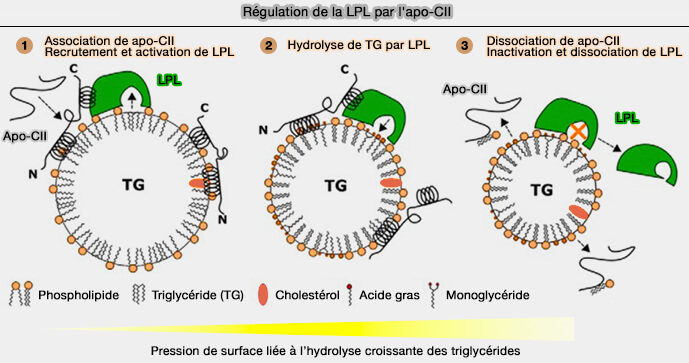
L'apoA-V et l'apoC-II sont les seuls activateurs de la LPL (LipoProtéine Lipase).
Structure de l'apoC-II
1. ApoC-II est composé de 79 acides aminés après le clivage d'un peptide signal de 22 acides aminés.
L'apoC-II n'est pas glycolysée.

(Figure : vetopsy.fr)
2. L'apoC-II ne contient que 3 hélices.
a. La première hélice (résidus 16 à 36), est amphipathique avec une grande face hydrophobe et une autre hydrophile, qui lui permet de se lier étroitement à une surface lipidique.
b. La deuxième hélice comprend que les résidus 50 à 56.
c. La troisième hélice sur l'extrémité C-terminale (résidus 63−76) serait responsable de l'activation de la LPL (LipoProtéine Lipase).
Les résidus Tyr-63, Ile-66, Asp-69 et Gln-70 sont supposés former un site de liaison pour résidus d'acides aminés spécifiques près de la région du couvercle de la LPL, ce qui conduirait à son activation en guidant le déplacement des triglycérides (TG) dans l'entrée du site actif (Site-directed Mutagenesis of Apolipoprotein CII to Probe the Role of Its Secondary Structure for Activation of Lipoprotein Lipase 2010).
Mécanisme de l'apoC-II
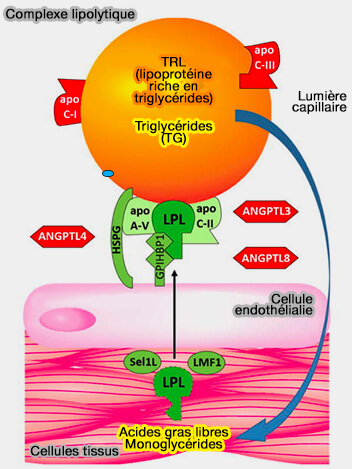
(Figure : vetopsy.fr d'après Wolska et coll)
La liaison initiale de l'apoC-II et de la LPL (LipoProtéine Lipase) aux lipoprotéines dépend de la pression de surface (A Pressure-dependent Model for the Regulation of Lipoprotein Lipase by Apolipoprotein C-II 2015).
1. Les deux protéines se lient facilement à la TRL (lipoprotéines riches en triglycérides) nouvellement sécrétée, qui a une pression de surface relativement faible.
- L'apoC-II, en solution, est largement dépliée, mais la liaison à la TRL va lui permettre de former des hélices N- et C-terminale qui sont en contact avec la surface lipidique.
- L'adsorption d'apoC-II augmente la pression de surface des lipoprotéines locales.
2. Au fur et à mesure que la LPL hydrolyse les triglycérides (TG), le noyau de la lipoprotéine rétrécit et la densité de surface locale des lipides et des protéines amphipathiques augmente.
- L'accumulation transitoire d'acides gras et de monoglycérides (MG) à la surface, associée à une perte de grandes quantités de TG, entraîne une pression de surface locale élevée.
- Cette augmentation de pression induit une désorption de l'hélice C-terminale de l'apoC-II, i.e. celle qui interagit avec la LPL pour favoriser l'hydrolyse des TG, car moins de surface est disponible pour chaque molécule de protéine.
3. Finalement, la pression de surface sur les particules restantes devient trop élevée.
- L'apoC-II se désorbe de la surface de la lipoprotéine et élimine certains phospholipides (PL) avec elle.
- La LPL est déplacée, arrêtant ainsi toute nouvelle lipolyse.
(Figure : vetopsy.fr d'après Meyers et coll)
ApoC-II et HDL

Les HDL (lipoprotéines de haute densité) servent de particule de transport et de réservoir pour l'apoC-II et la plupart des apolipoprotéines échangeables.
Lorsqu'une HDL rencontre une lipoprotéine avec un diamètre plus grand et une surface moins encombrée, ce qui est souvent le cas car ce sont les lipoprotéines de plus petite taille, certaines apolipoprotéines liées aux HDL peuvent être transférées sur la plus grosse particule.
-
Le noyau des TRL est riche en triglycérides (TG), et lorsqu'ils sont hydrolysés, la couche externe se comprime et augmente sa courbure.
- Ces changements provoquent la libération à la fois d'apolipoprotéines et de certains lipides polaires de la particule qui peuvent être captés par la HDL et réutilisés pour un autre cycle.
Retour aux apoC
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


