Domaines protéiques
Domaines protéiques d'interaction membranaire
Domaine C1

Le domaine C1 (phorbol esters/diacylglycerol binding domain) se lie au second messager DAG et aux esters de phorbol.
DAG et les esters de phorbol peuvent stimuler directement la PKC (protéine kinase C), la sérine-thréonine kinase.
Domaine C1
Structure
Les domaines C1, d'environ 50 résidus, recrutent les protéines aux membranes.
1. Le domaine C1, structure compacte riche en cystéines et qui comprend 2 histidines pour chélater deux ions zinc, comporte en général :
-
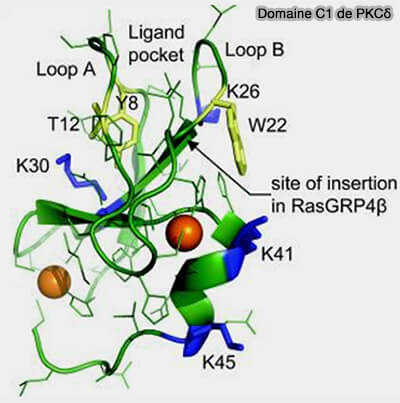
Domaine C1 de PKCδ
(Figure : vetopsy.fr d'après Jonhson et coll) - une hélice courte,
- 2 boucles saillantes qui s'insèrent dans les membranes en forment une poche pour la liaison au ligand (Crystal structure of the Cys2 activator-binding domain of protein kinase Cδ in complex with phorbol ester 1995 et Structural Mechanism for Lipid Activation of the Rac-Specific GAP, β2-Chimaerin 2004).
2. Le domaine C1 va souvent par paire, C1A et C1B, qui ne sont pas équivalents pour la liaison lipidique et la translocaltion, comme dans les PKC (protéine kinase C).
Rôles du domaine C1
Les domaines C1 ciblent les membranes, mais tous les domaines C1 n'ont pas exactement la même structure, i.e. ce phénomène se reflète dans leurs interactions (Taxonomy and function of C1 protein kinase C homology domains 1997).
1. Les domaines C1 canoniques ou typiques, se lient, en général, au :
- DAG comme C1b, deuxième domaine C1 de PKCδ (Structural Basis of Protein Kinase C Isoform Function 2008) ou celui de la β2-chimérine (Structural Mechanism for Lipid Activation of the Rac-Specific GAP, β2-Chimaerin 2004).
- aux esters de phorbol grâce aux boucles saillantes.

Vous pouvez lire pour une description précise des interactions : Structural anatomy of Protein Kinase C C1 domain interactions with diacylglycerol and other agonists (2022).
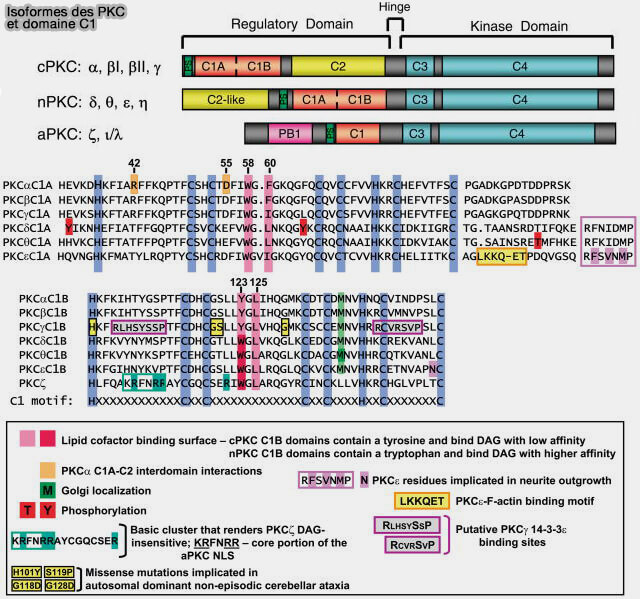
(Figure : vetopsy.fr d'après Steinberg)
2. Certains domaines C1, appelés souvent atypiques, comme ceux de Raf-1 et KSR (Kinase Suppresseur de Ras), ne se lient ni au DAG ni aux esters de phorbol (Raf-1 Cysteine-Rich Domain Increases the Affinity of K-Ras/Raf at the Membrane, Promoting MAPK Signaling 2018).
- Ils interagissent avec d’autres lipides, tels que les céramides ou la phosphatidylsérine (PS, et aident même à la reconnaissance des GTP-Ras (A Ceramide-binding C1 Domain Mediates Kinase Suppressor of Ras Membrane Translocation 2009).
- Trois résidus basiques, Lys-144, Lys-148 et Lys-157, dans la région de la boucle (résidus 144-161) sont responsables de la fixation à la membrane.
3. Les domaines C1 sont impliqués aussi dans la liaison de certaines protéines comme (
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


