Enzymes
Groupe des hydrolases (EC 3)
GTPases : DSP (superfamille de la dynamine)
Dynamine : partenaires de fission
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Classification des enzymes
- Coenzymes
- Vitamines
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La dynamine fait partie de la superfamille de la dynamine (DSP : Dynamin Superfamily Proteins) qui comprend de nombreuses GTPases, de grande taille par rapport aux petites GTPases.
Les dynamines ont trois propriétés :
- 1. Elles s'auto-oligomérisent en hélices autour d'un tube membranaire (
oligomérisation de la dynamine).
- 2. Les changements conformationnels induits par les nucléotides conduisent à une constriction du polymère et donc de la membrane (
dynamine et GPT).
- 3. Les dynamines induisent la fission des cols membranaires par l'hydrolyse du GTP.
Deux modèles de fission sont envisagés :
Quelque soit le modèle, de nombreux partenaires se lient à la dynamine et leur rôle précis n'est pas bien déterminé (
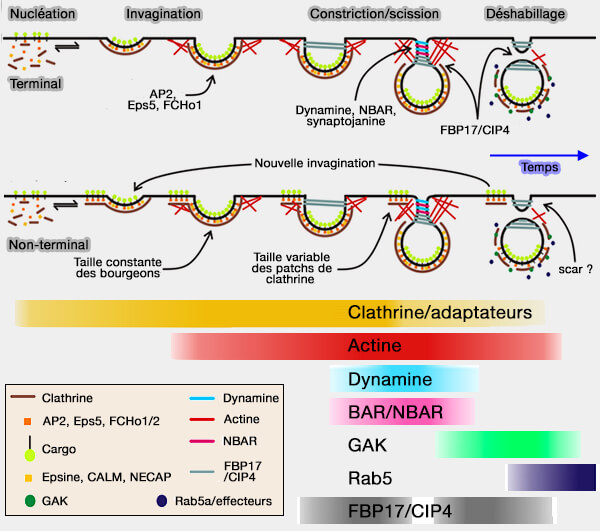
(Figure : vetopsy.fr d'après Taylor et coll)
Liaison aux domaines SH3 et BAR
Le domaine PRD C-terminal de la dynamine (riche en proline et en arginine) se lie au domaine SH3 ou aux domaines BAR (qui courbent les membranes) de nombreux partenaires de liaison.
1. En effet, ces protéines définissent le contexte dans lequel la dynamine doit agir en fonctionnant :
-
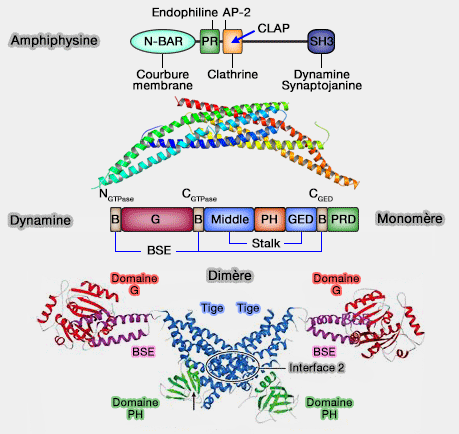
Amphiphysine et dynamine
(Figure : vetopsy.fr)détachement de la vésicule),
- comme coordonnateurs de son action avec celle d'autres protéines.
2. Ces interactions pourraient produire un goulot tubulaire incurvé de manière appropriée, conduisant à l'auto-assemblage d'hélices de dynamine autour d'eux.
Liaison aux domaines SH3
1. Certaines protéines à domaine SH3 qui se lie au PRD interagissent également avec :
- des protéines régulatrices de l'actine,
- des protéines de signalisation,
- des enzymes métabolisant les phosphoinositides membranaires.
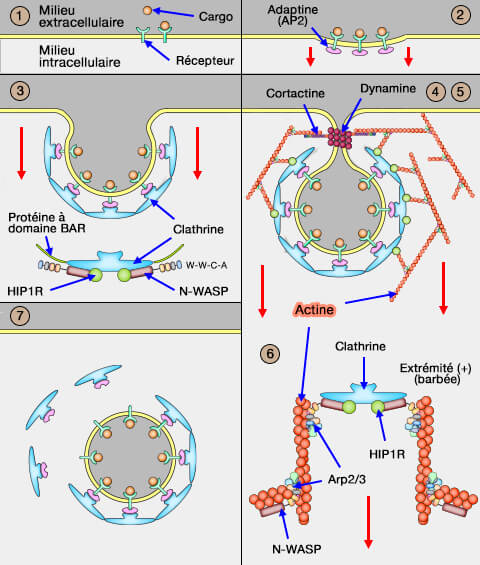
(Figure : vetopsy.fr)
2. L'endophiline, par exemple, recrute à la fois la dynamine et la synaptojanine et permet de coordonner la réaction de fission de l'endocytose avec la déphosphorylation de PI(4,5)P2 ou PIP2 dans les vésicules synaptiques (Recruitment of Endophilin to Clathrin-Coated Pit Necks Is Required for Efficient Vesicle Uncoating after Fission 2011).
Une telle réaction pourrait aider la dissociation de la dynamine et d'autres facteurs endocytaires de la membrane après la fission.
3. La cortactine joue aussi un rôle par la liaison de son domaine SH3 avec le domaine riche en proline de la dynamine (Cortactin Is a Component of Clathrin-Coated Pits and Participates in Receptor-Mediated Endocytosis 2003).
Liaison aux domaines BAR
La formation des tétramères de dynamine serait aussi dépendante de la courbure de la membrane générée par les protéines à domaine BAR auxquels elles se lient (Coordinated actions of actin and BAR proteins upstream of dynamin at endocytic clathrin-coated pits 2010).
1. Les données sur ce sujet sont contradictoires car une des questions clés est de savoir si ces protéines participent :
- soit directement à la réaction de fission,
- soit par un effet sur la courbure de la bicouche ou via leurs interactions avec la dynamine (Cooperative Recruitment of Dynamin and BIN/Amphiphysin/Rvs (BAR) Domain-containing Proteins Leads to GTP-dependent Membrane Scission 2013).
En effet, les protéines à domaine BAR ont tendance à se dimériser.
2. Par contre, la forme de croissant du domaine BAR pourrait bloquer la constriction par la dynamine en formant un échafaudage rigide de courbure fixe sur la membrane (Membrane Fission Is Promoted by Insertion of Amphipathic Helices and Is Restricted by Crescent BAR Domains 2012).
En outre, les barres du domaine BAR pourraient s'intercaler entre des modules GTPase de l'hélice de la dynamine et perturber l'interaction du domaine G-G nécessaire pour l'hydrolyse du GTP (An endophilin–dynamin complex promotes budding of clathrin-coated vesicles during synaptic vesicle recycling 2011).
Liaison au cytosquelette d'actine et aux myosines

Les relations entre dynamine et actine n'ont pas encore trouvé d'explications claires dans de nombreuses endocytoses (Structural organization and energy storage in crosslinked actin assemblies 2018).
On peut prendre comme exemple la fusion des ostéoclastes (Dynamin and endocytosis are required for the fusion of osteoclasts and myoblasts 2014).
Outre les puits d'endocytose, la dynamine est détectée dans les réseaux de polymérisation de l'actine (Arp2/3, protéine de nucléation et N-WASP, NPF d'activation…) dans :
-
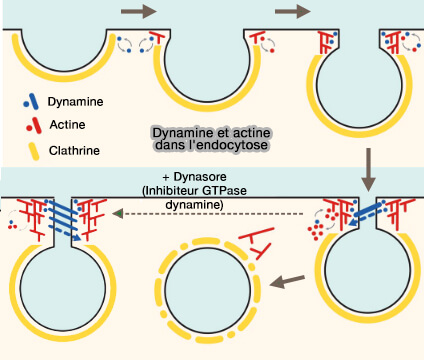
Dynamine et actine dans l'endocytose clathrine-dépendante
(Figure : vetopsy.fr d'après Grassart et coll) - les replis membranaires (ruffle),
- les podosomes,
- les invadopodes,
- les queues de comètes d'actine.
1. La colocalisation de la dynamine avec toutes ces protéines est médiée au moins en partie par les protéines contenant le domaine SH3 se liant à la dynamine, qui se lient également à N-WASP comme les complexes WAVE ou la cortactine.
La dynamine contrôle clairement la polymérisation de l'actine aux sites d'endocytose, au moins dans certains types de cellules (A Feedback Loop between Dynamin and Actin Recruitment during Clathrin-Mediated Endocytosis 2012 et Actin and dynamin2 dynamics and interplay during clathrin-mediated endocytosis 2014).
(Figure : vetopsy.fr d'après Kaksonen et Roux)
2. La colocalisation de l'actine et de la dynamine aux sites d'endocytose reflète la nécessité d'une force basée sur l'actine, via la polymérisation d'actine ou les moteurs de myosine, pour faciliter la fission dépendante de la dynamine (
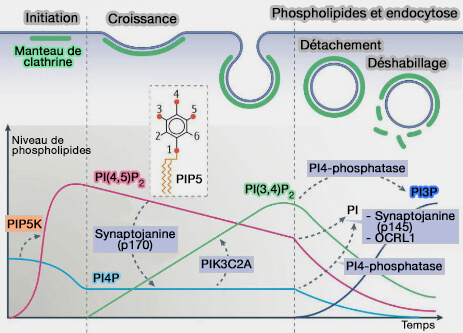
Et les phosphoinositides ?
La composition en phosphoinositides d'une vésicule d'endocytose évolue tout au long de l'endocytose (


