Moteurs moléculaires: myosines
Vue d'ensemble et classification
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation
Dans la cellule, de nombreux moteurs moléculaires (protéines motrices) sont fonctionnels, mais il en existe une seule sorte qui interagit avec les microfilaments d'actine : ce sont les myosines.
Vue d'ensemble des myosines
1. Les myosines, moteurs moléculaires des cellules eucaryotes, se trouvent :
- dans les cellules musculaires (striées ou lisses) où elles jouent alors un rôle essentiel dans la contraction musculaire,
- dans les cellules non-musculaires pour contribuer à la motilité des cellules, le trafic cellulaire, l'endocytose, la cytokynèse, l’apoptose…
Un autre rôle récemment découvert des myosines est de désassembler les réseaux d'actine.
2. Leurs propriétés sont :
- de se fixer sur l'actine-F,
- d’hydrolyser ATP,
- de se déplacer vers l’extrémité (+) des microfilaments (sauf la myosine VI qui se déplace à contre-sens).
Structure générale des myosines
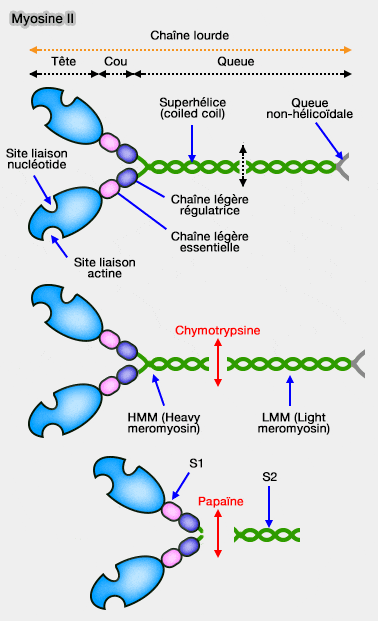
La structure des myosines est essentiellement dérivée des travaux sur les myosines II, en particulier celle du muscle strié squelettique où elle compose les filaments épais des myofilaments.
(Figure : vetopsy.fr)
La myosine II est la seule myosine responsable de toutes les contractions de notre corps. Il existe de nombreuses isoformes des chaînes lourdes et légères qui diffèrent selon les fibres musculaires (lentes ou rapides).
La molécule de myosine II est formée 6 polypeptides (hétérohexamère).
Chaînes lourdes (HC)
1. Les deux chaînes lourdes (HC ou Heavy Chain) forment l'armature (semblable à un club de golf).
La tête, composée par le domaine N-terminal de chacune des chaînes, contient les sites de liaison à l'actine et l'activité ATPasique.
Le cou, qui relie la tête à la queue, sert de levier pour faciliter les mouvements de la tête.
La queue (tige ou axe) est formé par l'entrelacement des deux chaînes lourdes et le domaine C-terminal est impliqué dans la liaison au cargo ou la dimérisation des chaînes lourdes.
2. C'est au niveau de la tête de myosine (tête S1) que se situe l'activité ATPasique et le site de liaison à l'actine qui augmente fortement cette activité.
On l'a découvert par l'action des protéases.
- la chymotrypsine (protéase douce) clive la myosine en méromyosine lourde (HMM : Heavy Meromyosin) et légère (LMM : Light Meromyosin).
- La papaïne sépare la HMM en deux fragments : la tête S1 (à activité ATPasique) et S2 (après le cou).
(Figure : vetopsy.fr)
Toutes les myosines ont cette structure générale avec une tête S1, c'est-à-dire tête et cou, qui se déplace vers l’extrémité (+) des microfilaments, et qui est responsable de son activité motrice.
Chaînes légères (LC)
Les chaînes légères (LC ou Light Chain), se liant au cou des chaînes lourdes, constituées de calmoduline ou de calmodulin-related protein (famille de protéines à mains EF (EF hand), sont de deux types.
1. Les chaînes légères essentielles (ELC ou Essential Light Chain) forment de véritables " colliers " qui enserrent les chaînes lourdes pour les rigidifier .
2. Les chaînes légères régulatrices (RLC) ou Regulatory Light Chains) jouent un rôle essentiel dans la modulation ATPasique des chaînes lourdes (par leur phosphorylation par exemple comme pour certaines myosines II - moteurs lents -). Elles pourraient également réguler l'interaction avec l'actine.
Classification des myosines
Les différentes isoformes de myosine sont caractérisées par des propriétés mécanochimiques distinctes (Kinetic Adaptations of Myosins for Their Diverse Cellular Functions 2016) :
- le taux d'hydrolyse de l'ATP,
- la processivité, i.e. capacité à faire plusieurs pas le long d'un filament d'actine,
- le rapport cyclique, i.e. fraction du cycle ATPase passé fortement attaché à l'actine,
- la vitesse de mouvement le long de l'actine.
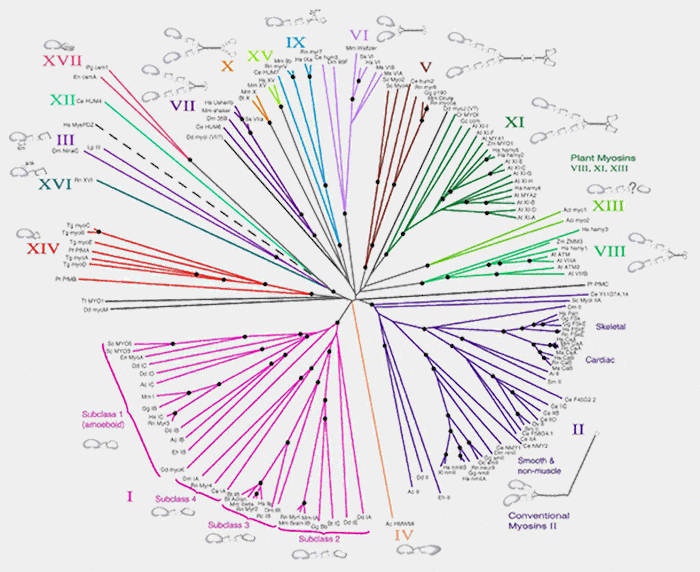
1. Sur la base de la séquence des têtes de la myosine, la superfamille est actuellement divisé en une vingtaine de classes (Myosin superfamily et Myosins: Tails (and Heads) of Functional Diversity 2005).
- Les myosines I, II, III, V, VI, VII sont très conservées phylogénétiquement (les III et VI sont uniquement exprimées chez les métazoaires).
- Les myosines X et XVI sont exprimés que chez les vertébrés alors que les myosines VIII et XIII ne sont retrouvées que chez les plantes.
- Les autres myosines (IV, XII, XIV, XVII) ont été identifiées dans une ou un petit nombre d'espèces.
(d'après mrc-lmb.cam.ac.uk)
Chez l'Homme, pas moins de 40 gènes sont impliqués.
- La première découverte a été la myosine de classe II qui joue un rôle dans la contraction du muscle squelettique.
- Puis, on a découvert plusieurs autres classes qui se déplacent le long de l'actine,

Pour plus de détails, consultez l'article : Drawing the tree of eukaryotic life based on the analysis of 2,269 manually annotated myosins from 328 species (2007).
(Figure : vetopsy.fr d'après Krendel)
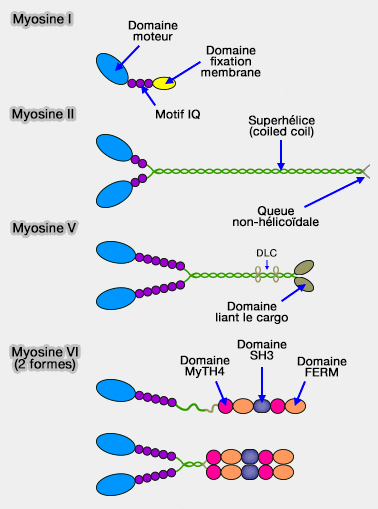
2. Les classes de myosine diffèrent par (Myosin Structure, Allostery, and Mechano-Chemistry 2013) :
- la longueur de leur cou qui détermine la vitesse du déplacement, i.e. le nombre de domaine IQ peut varier de 1 à 7,
- le type et le nombre de chaînes légères associées,
- la longueur de la queue qui représente la partie la plus variable de la myosine.
En outre, les domaines qui y sont incorporés sont nombreux, environ une vingtaine, et jouent un rôle essentiel dans les partenaires des myosines considérées et leur rôles (liaison à l'actine, transport de différents cargos…). comme :
- pour des interactions protéine-protéine, les domaines coiled oil, FERM, MyTH4 - Myosin tail homology 4 - ou SH3
- pour les liaisons lipidiques comme le domaine PH (Pleckstrin Homology).
Par exemple, les myosines III possèdent un domaine sérine/thréonine kinase qui peut s'autophosphoryler pour inhiber l'action ATPasique et diminuer l'affinité à l'actine. Les myosines de classe IX ont un domaine qui inhibe l'activité de la petite GTPase Rho…
Remarque : Les myosines peuvent également être classées différemment selon leurs propriétés mécaniques et cinétiques (
3. Les principales myosines appartiennent à trois classes.
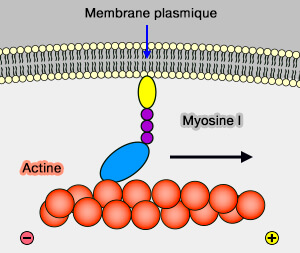
- Les myosines I, aux nombreux membres, sont associées à une membrane et à l'endocytose.
- Les myosines II, seules responsables des contractions, à nombreuses isoformes pour que la contraction soit individualisée selon son rôle dans les muscles (squelettiques, muscle cardiaque et muscles lisses) ou dans les cellules non-musculaires (motilité, migration cellulaire, adhésion et division cellulaire).
- Les myosines V se fixent sur des récepteurs spécifiques des organites pour les déplacer.
- La myosine IX est associée à la phagocytose.
4. Toutefois, certaines myosines ont des rôles particuliers.
- Les myosines VI sont les seuls moteur à fonctionner à contre-sens, i.e. vers l'extrémité (-).
- Les myosines X transportent les cargos le long des filaments d'actine.
- La myosine XI sert de marqueur aux CMLV (cellules musculaires lisses vasculaires ou léiomyocytes).


