Canaux ioniques : canaux sodiques (Na+)
Canaux sodium voltage-dépendants
(Nav) : liaisons entre β et α
Les canaux sodium voltage-dépendants sont formés :
- de sous-unités α, suffisantes pour former le canal Na+ (260 kD) pour le passage des ions,
- de sous-unités β (2 à 4) qui facilitent leur localisation membranaire et permettent la modulation de leurs propriétés.
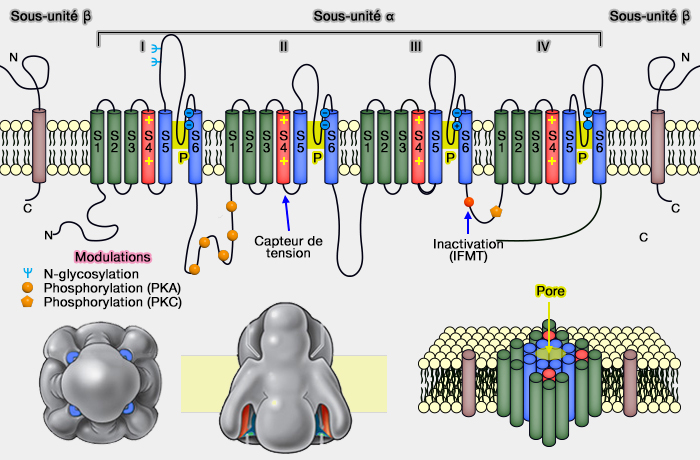
(Figure : vetopsy.fr)
La liaison entre les sous-unités β et α n'est pas encore bien élucidée. Toutefois, il semble que les liaisons peuvent être :
- extracellulaires,
- intracellulaires.
Liaisons intracellulaires

(Figure : vetopsy.fr d'après Namadurai)
Comme la sous-unité β1 est proche de β3, il est plausible que leurs régions intracellulaires se lient à des sites similaires sur la sous-unité α Nav1.5 extrémité carboxy-terminale (A Novel Epilepsy Mutation in the Sodium Channel SCN1A Identifies a Cytoplasmic Domain for β Subunit Interaction 2004).
- Or, on sait que cette extrémité est essentielle dans la liaison avec la porte d'inactivation pour stabiliser l'inactivation rapide (The Na+ Channel Inactivation Gate Is a Molecular Complex 2004).
- Les régions intracellulaires de β3 et β1 sont suffisamment longues pour former un complexe avec la sous-unité α carboxy-terminale et la porte d'inactivation.
Les sous-unités β faciliteraient ainsi cette inactivation rapide par cette liaison afin d'aligner de manière optimale le complexe entre la sous-unité α du domaine C-terminal et la porte d'inactivation, ce qui expliquerait les effets de mutations.
Liaisons extracellulaires
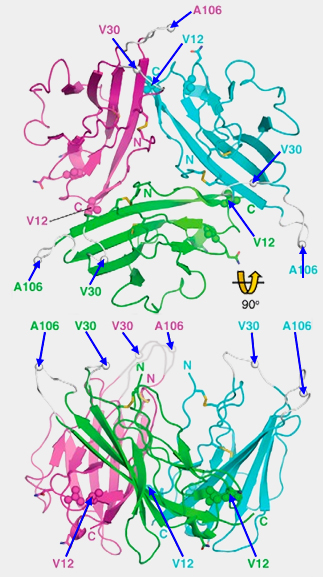
(Figure : vetopsy.fr d'après Namadurai)
L'hypothèse actuelle est que la sous-unité β se fixe sur un site de chaque sous-unité α, i.e. quatre sites donc (Voltage-gated sodium channels at 60: structure, function and pathophysiology 2012 et Crystal Structure and Molecular Imaging of the Nav Channel β3 Subunit Indicates a Trimeric Assembly 2013).
Toutefois, dans l'étude sur les β3, il semblerait qu'il y ait plusieurs sites de liaison par sous-unité α.
Les deux β1 et β3 peuvent interagir avec la sous-unité α proche de domaine IV.
- La lignocaïne, anesthésique local, se lie à l'hélice S6 du domaine IV [49], et les deux β3 et β1 atténuent l'effet de la lignocaïne (Lidocaine block of neonatal Nav1.3 is differentially modulated by co-expression of beta1 and beta3 subunits 2004).
- Un site de liaison pour le domaine Ig β1 a été localisé dans le domaine extracellulaire S5-S6 du domaine IV de Nav1.2, à localisation cérébrale (Functional Roles of the Extracellular Segments of the Sodium Channel α Subunit in Voltage-dependent Gating and Modulation by β1 Subunits 1999).
- Deux sites de liaison de β1 sur la sous-unité α Nav1.4 musculaire sont situées dans les régions extracellulaires reliant les hélices S5-S6 du domaine I et du domaine IV.
La sous-unité β3 est exprimée dans le coeur et joue un rôle important dans la physiologie cardiaque (arythmie cardiaque spontanée).
- La sous-unité β1, comme son homologue de β3, peut se complexer avec les sous-unités α de Nav1.5 (The β1-subunit of Na(v)1.5 cardiac sodium channel is required for a dominant negative effect through α-α interaction 2012).
- Cette liaison explique l'importance des mutations, en particulier Val86, mais aussi Val12, val30 et Ala106.
Les sites de N-glycosylation, i.e. N85 and N89, mais aussi N71 et N97 (N ou Asn, asparagine), sont aussi essentiels à la modulation des sous-unités.
- Ils se retrouvent en surface de chaque protomère.
- Leur glycosylation peut inhiber la formation d'oligomères.


