Biologie cellulaire
Matrice extracellulaire
(ECM)
Fibres élastiques : élastine
- En construction

L’élastine est une protéine de la matrice extracellulaire (ECM) très élastique et présente dans le tissu conjonctif pour lui permettre de reprendre sa forme après un étirement ou une contraction.
Les fibres élastiques sont essentielles au fonctionnement physiologique de nombreux organes comme les artères, la peau, les tendons ou les poumons, qui subissent des déformations réversibles et répétitives (
Les fibres élastiques se composent de deux composants morphologiquement distincts :
- un noyau dense d’élastine réticulée, qui représente plus de 90 % de la teneur des fibres,
- un manteau de microfibrilles à base de fibrilline, mais avec d'autres molécules associées, alignées longitudinalement (
structure des fibres élastiques).
Structure de l'élastine
L’élastine est un biopolymère insoluble composé d’unités de son précurseur soluble, la tropoélastine (TE).

Vous pouvez lire : A guide to the composition and functions of the extracellular matrix (2021).
Tropoélastine
1. La structure primaire de TE est caractérisée par une alternance de domaines hydrophobes et hydrophiles, qui sont codés par des exons distincts.
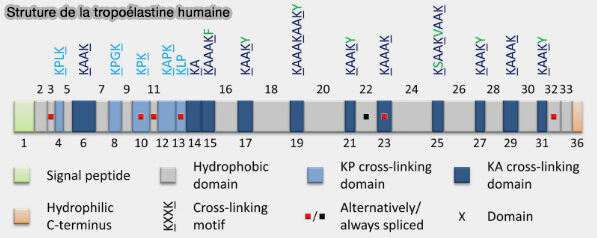
(Figure : vetopsy.fr d'après Karamanos et coll)
a. Les domaines hydrophiles sont impliqués dans la réticulation covalente induite par les enzymes LOX ou LOXL, conduisant à l’élastine mature et contiennent (Unique molecular networks: Formation and role of elastin cross-links 2019) :
- soit des motifs lysine-alanine (KA) dans lesquels les résidus de lysine se présentent sous forme de paires ou de triplets séparés par deux ou trois résidus d’alanine, i.e. par exemple AAAKAAKAA),
- soit des motifs lysine-proline (KP), dans lesquels les résidus de lysine sont séparés principalement par des résidus de proline, i.e. par exemple KPLKP.
b. Les domaines hydrophobes, cependant, sont responsables de l’élasticité et sont impliqués dans les interactions cellulaires.
Remarque : le transcrit primaire de l’élastine subit un épissage alternatif étendu, ce qui donne de nombreuses isoformes ( A comprehensive map of human elastin cross-linking during elastogenesis 2019).
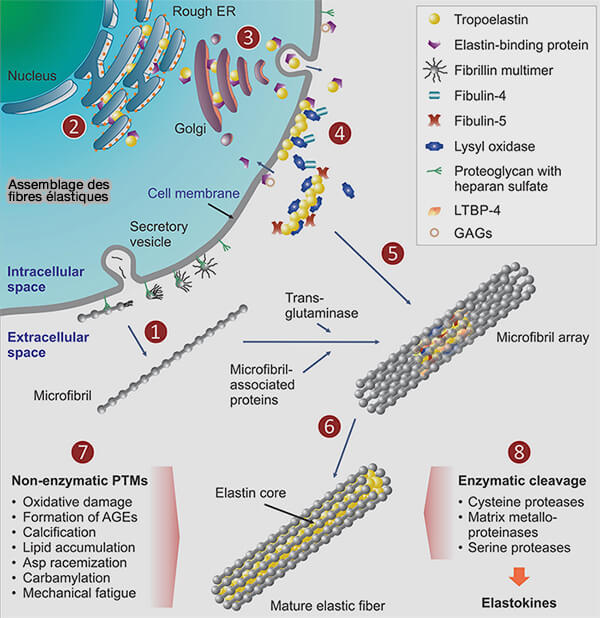
2. La tropoélastine s’agrège à la température physiologique en raison des interactions entre les domaines hydrophobes dans un processus appelé coacervation, conduisant à la formation d'agrégats globulaires distincts sur la membrane cellulaire (Role of Liquid–Liquid Phase Separation in Assembly of Elastin and Other Extracellular Matrix Proteins 2018).
Un coacervat est une phase aqueuse riche en macromolécules formée par séparation de phase liquide-liquide (LLPS), conduisant à une phase dense en équilibre thermodynamique avec une phase diluée.
- Les protéoglycanes (PG) peuvent interagir dans ce coacervat pour faciliter l'alignement correct des monomères TE, via leur domaine C-terminal, COOH.
- L'alignement de TE et la réticulation ultérieure sont en outre favorisés par les fibulines, i.e. fibuline-4 et fibuline-5, qui sont impliquées dans l'association entre TE et l'amine extracellulaire dépendante de Cu++ de LOX et LOXL (
asssemblage des fibres élastiques).
(Figure : vetopsy.fr d'après Schmelzer et coll)
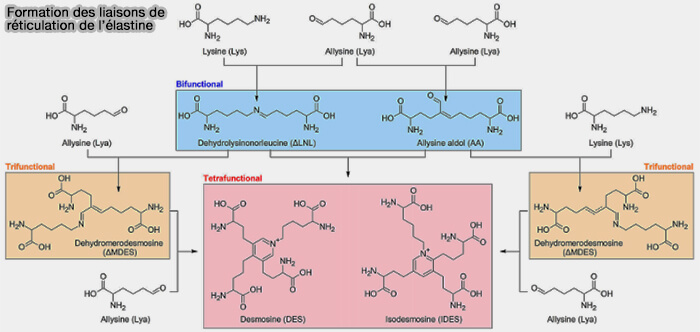
3. Pour former des fibres d’élastine matures, les molécules de tropoélastine subissent une réticulation via leurs résidus de lysine qui forment des desmosines et des isodesmosines, composées de 4 lysines.
Les enzymes LOX et LOXL catalysent la désamination oxydative du groupe ɛ-amino de résidus Lys à l'allysine, conduisant à la formation d'une variété de liens croisés entre (Lysyl oxidase–like 2 (LOXL2)–mediated cross-linking of tropoelastin 2019).
(Figure : vetopsy.fr d'après Schmelzer et coll)
Élastine mature
L'élastine est une chaîne polypeptidique non ordonnée (Mechanical Properties and Functions of Elastin: An Overview 2023).
1. Elle est constituée majoritairement de glycines (30%) et de prolines (12%).
- Cette particularité fait que, dans le monomère d’élastine entouré d’eau, la formation d’une structure secondaire ordonnée est empêchée (Proline and Glycine Control Protein Self-Organization into Elastomeric or Amyloid Fibrils 2006).
- L’angle dièdre φ fixe et le manque d’hydrogène amide de la proline, ainsi que la flexibilité de la petite glycine, font que leurs séquences empêchent la formation d’un noyau compact, excluant l’eau, qui maintient un degré élevé de désordre structurel et permet aux molécules d’eau de se propager parmi le réseau d’élastine.
2. Les molécules d’eau du solvant agissent sur l’élastine comme un plastifiant en interagissant avec l’eau liée à la chaîne principale, ce qui permet à la chaîne d’être plus mobile (Molecular basis for the extensibility of elastin 2002).
- Bien que les séquences d’acides aminés hydrophobes empêchent la formation de grandes structures secondaires, la dynamique du squelette hydraté de la molécule d’élastine entraîne des hélices transitoires par des liaisons hydrogène, qui forment des assemblages hautement désordonnés, mais pas aléatoires, de conformations dynamiques telles que des structures bêta courtes et labiles et des hélices de polyproline II (Dynamics in natural and designed elastins and their relation to elastic fiber structure and recoil 2021).
- Les domaines de réticulation hydrophiles et riches en alanine peuvent également contribuer de manière significative aux conformations complexes de l’élastine (A Two-State Model Describes the Temperature-Dependent Conformational Equilibrium in the Alanine-Rich Domains in Elastin 2020).
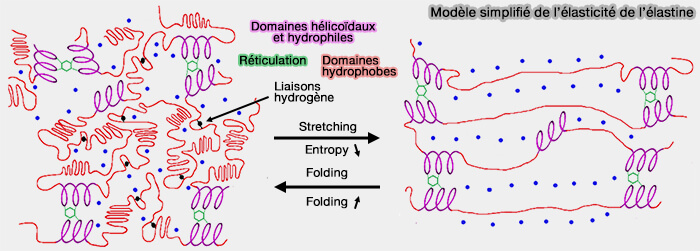
(Figure : vetopsy.fr d'après Trębacz et Barzycka)
3. Un modèle simplifié serait le suivant (Mechanical Properties and Functions of Elastin: An Overview 2023).
- Dans l'état replié, i.e. natif, les prolines et les glycines empêchent l’effondrement des domaines hydrophobes, ce qui permet aux molécules d’eau de se propager parmi le réseau d’élastine.
- Dans l'état étendu, l’extension de l’élastine entraîne une diminution de l’entropie conformationnelle des chaînes polypeptidiques et augmente les interactions hydrophobes avec les résidus hydrophobes exposés.
- L’effet hydrophobe et l’entropie conformationnelle de la chaîne entraînent le recul élastique des molécules d’élastine étirées et le retour à l'état natif.
Fonctions et maladies liées à l'élastine
1. L’élastine mature est métaboliquement stable tout au long de la vie, i.e. sa demi-vie chez l’homme a été déterminée à 70 ans environ.
a. L’une des raisons de cette durabilité exceptionnelle est la haute résistance de l’élastine à la protéolyse, qui est principalement causée par sa nature largement réticulée et l’empilement extrêmement dense des molécules.
b. Toutefois, le pendant de cette propriété est que l’élastine est soumise à diverses réactions chimiques, qui induisent un vieillissement moléculaire responsable d’altérations progressives de ses propriétés structurelles et fonctionnelles, notamment l’oxydation, la racémisation de l’acide aspartique, la glycation ou la carbamylation.
2. Ce vieillissement moléculaire de l’élastine est concomitant au vieillissement chronologique de l’organisme, mais peut également être intensifié au cours de maladies chroniques telles que le diabète sucré, l’insuffisance rénale terminale ou l’athérosclérose.
Les conséquences du vieillissement moléculaire de l’élastine sont multiples, allant des impacts directs sur les propriétés structurelles et mécaniques de cette protéine matricielle à des effets inappropriés sur les cellules (Toward a rational therapeutic for elastin related disease: Key considerations for elastin based regenerative medicine strategies 2025).
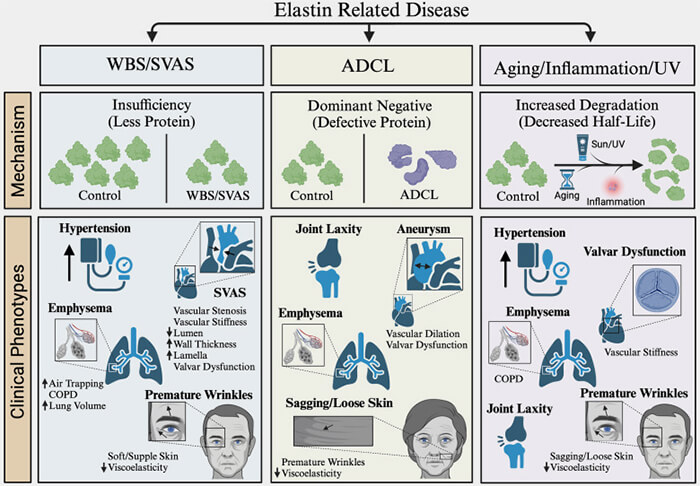
(Figure : vetopsy.fr d'après Ganjibakhsh et coll)
3. On trouve aussi des maladies génétiques liées au gène de l'élastine (Elastin-Driven Genetic Diseases 2021).
Retour à la matrice extracellulaire
En construction


