Constituants cellulaires
Cytosquelette : microtubules
Centrosome : vue d'ensemble
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le centrosome, constitué d’une paire de centrioles entourée d’un matériel péricentriolaire riche en facteurs de nucléation, coordonne l’organisation des microtubules, l’interaction avec le réseau d’actine et l’orientation dynamique du fuseau mitotique au cours du cycle cellulaire.
L'appellation centrosome vient du latin centrum, i.e. centre, et du grec, sōma, i.e. corps.
Les champignons et les plantes, sans centrosome, utilisent d'autres structures pour organiser leurs microtubules.
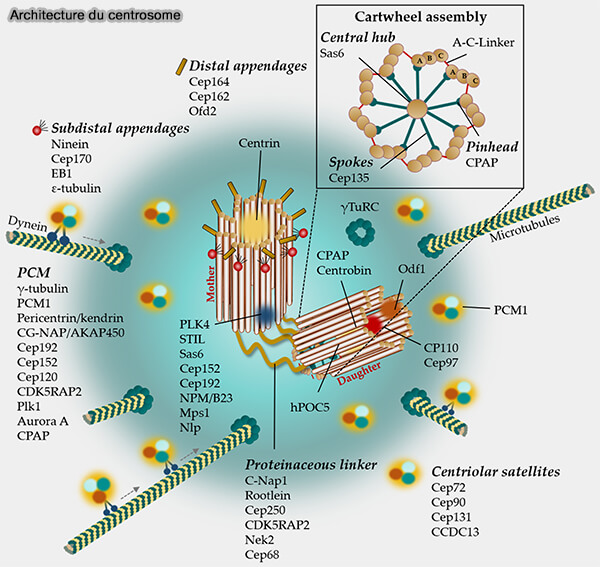
Vue d'ensemble de la structure du centrosome
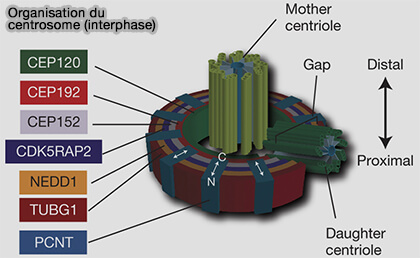
1. Le centrosome des cellules animales est constitué d’une paire de centrioles disposés orthogonalement, entourés d’un matériel péricentriolaire (PCM) dense.

(Figure : vetopsy.fr d'après Winey et o'Toole)
Cette organisation hiérarchisée crée une unité structurale unique capable de coordonner l’architecture microtubulaire de la cellule et de piloter la dynamique du fuseau mitotique.
Remarque essentielle : bien que le centrosome soit classiquement défini comme " une paire de centrioles entourée d’un matériel péricentriolaire (PCM) ", cette définition ne décrit correctement que l’état de la phase G1 du cycle cellulaire.
- Au cours de la phase S, puis de la phase G2, chaque centriole mère génère un centriole fille, de sorte que le centrosome contient deux paires centriole mère-centriole fille, tout en restant une structure unique, un seul centrosome, tant que ces paires partagent un seul PCM commun.
- Il est important de garder cette nuance en mémoire, car de nombreux schémas ou articles simplifient encore cette définition et peuvent laisser croire, à tort, qu’une paire mère-fille équivaut toujours à un centrosome.
2. Le centrosome constitue le MTOC (MicroTubule-Organizing Center) principal des cellules animales.
Les autres structures capables de nucléer des microtubules, qui pourraient bénéficier de cette appellation au sens strict, i.e. Golgi, cortex, kinétochores, réseaux acentrosomaux, peuvent agir comme MTOC secondaires, mais ne remplissent pas la fonction d’organisation globale conférée au centrosome, qui reste le MTOC principal de la cellule animale. (
Couple centriolaire : gabarit structural du centrosome
1. Chaque centriole est un cylindre court, rigide et hautement organisé, composé de neuf triplets de microtubules disposés en symétrie radiale 9×3.
(Figure : vetopsy.fr d'après Bühler et Stolz)
2. Les deux centrioles, centriole mère et centriole fille, forment un couple asymétrique à l’origine de la polarité et de la dynamique du centrosome.

La structure, la duplication et la maturation des centrioles sont étudiées dans des chapitres spécifiques.
Matériel péricentriolaire (PCM)

(Figure : vetopsy.fr d'après Fry et coll)
Vue d'ensemble
1. Le matériel péricentriolaire (PCM ou PeriCentriolar Material) constitue une matrice protéique amorphe, riche en protéines à domaines coiled-coil et en complexes multiprotéiques spécialisés (Recent advances in pericentriolar material organization: ordered layers and scaffolding gels 2017).
a. Le PCM assure :
- la nucléation des microtubules, via la γ-tubuline et les complexes γ-TuRC,
- l’ancrage et la stabilisation des microtubules,
- le recrutement de nombreux régulateurs du cycle cellulaire, notamment ceux impliqués dans la maturation en G2/M, en particulier les kinases mitotiques, i.e. Plk1, Aurora A complexe cycline B/CDK1 (MPF).
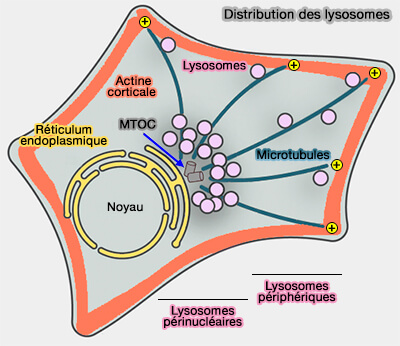
(Figure : vetopsy.fr d'après Cabukusta et coll)
b. Cette matrice confère au centrosome sa capacité à devenir le principal MTOC (centre organisateur des microtubules) des cellules animales et à coordonner la formation et l’orientation du fuseau mitotique.
2. La composition moléculaire du matériel péricentriolaire demeure extrêmement complexe et encore incomplètement élucidée.
- Les catalogues actuels reposent sur des approches de protéomique, d’imagerie à haute résolution et de génétique fonctionnelle, mais restent dépendants du contexte cellulaire et de l’état du cycle.
- Les interactions décrites doivent donc être interprétées avec prudence, comme des modèles évolutifs plutôt que comme un inventaire définitivement stabilisé.
3. Sans entrer dans le détail de chaque composant, nous en proposons une présentation générale, destinée à situer les principaux éléments du PCM.
Charpentes structurales et réseau de protéines à hélices coiled-coil
Ces protéines, à longues hélices coiled-coil, forment un treillis tridimensionnel et organisent l’ensemble du matériel péricentriolaire pour :
- structurer et maintenir la cohésion du PCM,
- mettre en place des plateformes d’interaction,
- positionner et réguler les modules nucléateurs et mitotiques pour conférer la plasticité nécessaire à la réorganisation rapide du PCM en G2/M sous l’effet des kinases mitotiques.
Péricentrine (PCNT)
La péricentrine (PCNT), d'environ 3336 résidus, est un élément central de la charpente (
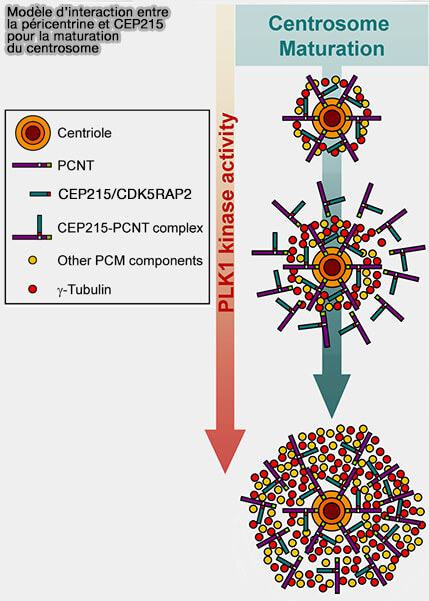
(Figure : vetopsy.fr d'après Kim et Rhee)
1. Elle sert de " poutre maîtresse " pour le recrutement des complexes γ-TuRC.
- Elle contribue à la stabilité du PCM en interphase.
- Elle conditionne son expansion en G2/M.
- Elle sert d'ancrage et de cordination pour NEDD1 et CDK5RAP2.
Son domaine PACT (Pericentrin-AKAP450 Centrosomal Targeting domain) C-terminal de 80 à 100 résidus, selon les espèces, 3230-3336 environ, est nécessaire et suffisant pour (The PACT domain, a conserved centrosomal targeting motif in the coiled-coil proteins AKAP450 and pericentrin 2000) :
- ancrer PCNT au centrosome,
- localiser AKAP450 (appareil de Golgi) et d’autres protéines coiled-coil,
- organiser les couches internes du PCM.
2. Sa phosphorylation dépendante de Plk1 déclenche un recrutement extensif du γ-TuRC pour la formation d’asters mitotiques très denses, nécessaires à la construction du fuseau.
CEP192
CEP192 constitue un pivot structural majeur pour l’assemblage et la maturation du PCM.
1. Il orchestre la cascade Aurora A-Plk1, étape essentielle à la mise en place d’un centrosome compétent (The Cep192-organized Aurora A-Plk1 cascade is essential for centrosome cycle and bipolar spindle assembly 2015).
a. Plk1 est efficacement recrutée sur le centriole mère via CEP192, puis phosphoryle :
- PCNT et CDK5RAP2 (CEP215),
- d’autres composants du treillis PCM, i.e. NEDD1, CEP135…, consolidant l’expansion radiale du PCM et la capacité de nucléation.
b. La coordination de l’activation d’Aurora A, de Plk1 et du complexe cycline B/CDK1 (MPF) pilote l’expansion du PCM en G2/M, rendant le centrosome pleinement compétent pour l’entrée en mitose en augmentant sa capacité de nucléation microtubulaire et la formation des asters.
2. Sans CEP192, le centrosome reste incompétent pour former des asters mitotiques.

(Figure : vetopsy.fr d'après Joukov et coll)
CEP152
1. CEP152 sert d’ancrage à PLK4 sur le centriole mère et structure les premières étapes de la duplication centriolaire en assurant (Centrosomal organization of Cep152 provides flexibility in Plk4 and procentriole positioning 2023) :
- la coordination de la duplication du centriole, car l’ancrage proximal de PLK4 active localement le module STIL-SAS-6 et initie l’assemblage du procentriole,
- l’organisation du PCM, CEP152 contribuant indirectement au recrutement de facteurs structuraux comme CEP192, indispensable à la formation du treillis coiled-coil et à la maturation progressive du centrosome.

(Figure : vetopsy.fr d'après Joukov et coll)
2. Le modèle montre que CEP152 arrache PLK4 au complexe CEP192-PLK4 et repositionne PLK4 à la limite extérieure d’une structure en anneau Cep152 nouvellement formée (Molecular Basis for Unidirectional Scaffold Switching of Human Plk4 in Centriole Biogenesis 2015).
a. Les premiers centrioles filles de G1 sont entourés d’un cylindre CEP192 dont l’extrémité N est orientée vers l’extérieur.
À ce stade, PLK4 adopte une distribution annulaire restreinte (∼ 440 nm de diamètre), dépendante de son interaction avec la région N-terminale de CEP192.
b. Lorsque CEF152 est recruté en fin de G1, il capture PLK4 associé à CEP192 et le dissocie de son ancrage initial.
L’extension radiale d’un anneau Cep152 autour du toroïde Cep192 entraîne alors un repositionnement de Plk4 vers le bord externe de cette nouvelle structure, générant un anneau Plk4 élargi (∼600 nm).
c. Au moment de la formation du procentriole, PLK4 cesse d’être distribué en anneau et se concentre en un foyer unique au site d’initiation, où il recrute SAS-6, déclenchant l’assemblage du procentriole.
Complexes nucléateurs de la tubuline
(Figure : vetopsy.fr d'après Lawo et coll)
Le PCM concentre les cofacteurs essentiels permettant l’ancrage et l’activation des complexes γ-TuRC.
NEDD1 et CDK5RAP2 fixent et stabilisent ces modules nucléateurs au plus près des centrioles.
Cette organisation fait du centrosome le MTOC principal de la cellule, en contrôlant la localisation et l’efficacité de la nucléation des microtubules (

Les complexes γ-TuRC et la nucléation centrosomale sont étudiés dans des chapitres spécifiques.
Modules d’ancrage et de stabilisation des microtubules
1. Les modules d’ancrage et de stabilisation des microtubules désignent l’ensemble des mécanismes par lesquels les appendices subdistaux du centriole mère assurent l’attache, l’orientation et le maintien mécanique du réseau microtubulaire cytoplasmique.
Ces modules reposent principalement sur l’action coordonnée de :
- de la ninéine, qui organise la plateforme d’ancrage,
- de la dynéine, qui convertit cette organisation spatiale en forces de traction actives.

Les modules d’ancrage et de stabilisation des microtubules sont étudiés dans un chapitre spécifique.
2. Ils assurent la transition fonctionnelle entre la nucléation des microtubules au niveau du PCM et l’établissement d’un réseau microtubulaire stable, polarisé et radial, condition indispensable :
- à la polarité cellulaire,
- au positionnement et à la séparation des pôles,
- à la mise en place correcte du fuseau bipolaire.
Plateforme d’activation des kinases mitotiques
Le PCM concentre plusieurs kinases mitotiques majeures, notamment Plk1, Aurora A et le complexe cycline B/CDK1 (MPF), dont l’activité locale contribue à :
- l’expansion du PCM,
- l’augmentation de la capacité nucléatrice du centrosome,
- la formation des asters mitotiques nécessaires à la séparation des pôles.
Cycle et duplication des centrosomes
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


