Potentiels membranaires
Techniques de mesure : patch-clamp
- Neurophysiologie
- Potentiels
membranaires
- Notions d'électricité
- Potentiels
membranaires
- Vue d'ensemble
- Techniques de mesure
- Potentiel de membrane
- Potentiel de repos
- Potentiel d'action
- Potentiel gradué
- Vue d'ensemble
- Potentiels postsynaptiques
- Potentiels postsynaptiques excitateurs (PPSE)
- Potentiels postsynaptiques inhibiteurs (PPSI)
- Sommations spatiales et temporelles des PPS
- Conclusion générale sur l'efficacité synaptique
- Potentiels récepteurs
- Circuits neuronaux
- Neurotransmetteurs
- Récepteurs membranaires
- Synapses

Le patch-clamp, associé au voltage clamp, permet d'interpréter les phénomènes de potentiels membranaires au niveau d'un canal ionique
La membrane se comporte comme un circuit avec un condensateur et une résistance placée en parallèle.
Pour les mesures, on utilise le plus souvent la technique du potentiel stabilisé ou potentiel imposé (voltage clamp).
(Figure : vetopsy.fr d'après Lourdel)
En 1976, la méthode dite du patch-clamp, " patch " pour une très petite partie de membrane neuronale, fut mise au point par Erwin Neher et Bert Sakmann (Single-channel currents recordes from membrane of denervated frog muscle fibres).
Elle a révolutionné l'étude des courants ioniques par l'enregistrement des processus en action dans un canal unique.
Principe général
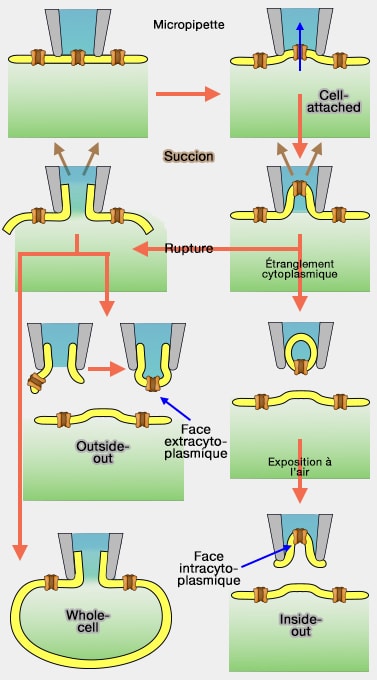
Une pipette contenant une solution conductrice est positionnée sur la membrane cellulaire comportant les canaux ioniques.
- Elle est reliée à un système identique au voltage clamp, i.e. un amplificateur qui impose des potentiels et mesure des courants.
- On peut faire la manipulation inverse, i.e. on impose des courants et on mesure des potentiels (current clamp).
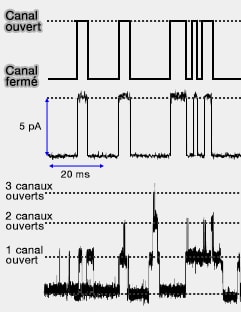
1. Les courants mesurés sur un canal sont très faibles, de l'ordre de $10^{-12}$ ampère ou picoampère.
Sur la figure ci-contre, on voit l'enregistrement des courants qui signale l'ouverture des canaux. Leur amplitude est identique pour le dernier enregistrement, ce qui démontre que ce sont des canaux identiques.
a. On doit donc éviter les fuites.
- Par une légère succion, la membrane se colle hermétiquement à la pipette (scellement, joint ou seal).
- Les ions qui traversent le canal lors de son ouverture passent obligatoirement par la pipette et créent un courant mesurable grâce à l'amplificateur.
b. Cette méthode est appelée patch-clamp en " cellule attachée " (cell-attched), i.e. la membrane n'est pas déchirée.
(Figure : vetopsy.fr)
2. Cette configuration est utilisée lorsque l'activité du canal nécessite un facteur intracytoplasmique, ou une liaison avec des protéines du cytosquelette.
Autres configurations
D'autres configurations sont possibles selon la force de la succion, par exemple.
Patch cellule entière
(whole-cell)
Le patch-clamp cellule entière (whole-cell) est obtenu en appliquant une forte succion sur la membrane, ce qui provoque sa déchirure.
La pipette est en contact avec le cytoplasme cellulaire en entier et permet donc les mesures des potentiels et des courants globaux.
Cette méthode permet en outre d'injecter des substances dans le cytoplasme pour des expériences.
Patch inside
(single channel)
Les autres patch-clamp (inside-out et inside-in) permettent de mesurer les courants qui traversent un seul canal (single-channel).
Ils sont réalisés par l'arrachage de la petite partie membranaire scellée sur la pipette, i.e. le reste de la cellule n'intervient plus.
1. Le patch inside-out est effectué à partir du patch cellule attachée.
- On aspire et on emmène une partie de membrane dont la face intracellulaire est donc située à l'extérieur de la pipette.
- On peut également changer la composition du milieu qui est au contact avec cette face et étudier les modulations intracellulaires de ce canal par différentes molécules.
2. Le patch outside-out est effectué à partir du patch cellule entière.
- On aspire et on emmène une partie de membrane dont la face extracellulaire est donc située à l'extérieur de la pipette par la soudure (cf. figure).
- On peut alors étudier les modulations extracellulaires de ce canal, et en particulier l'action des neurotransmetteurs pour les canaux activés par fixation d'un ligand, comme le récepteur nicotinique à l'acétylcholine ou les récepteurs GABAA.


