Cytosquelette
Filaments intermédiaires (IF) : structure et assemblage
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les filaments intermédiaires possèdent une structure fibrillaire commune et s’assemblent spontanément en un réseau non polarisé assurant la stabilité mécanique des cellules eucaryotes.
(Figure : vetopsy.fr d'après Klymkowsky)
Ils dérivent tous d'un gène ancestral commun et sont codés à l'heure actuelle par une cinquantaine de gènes (Intermediate filaments: new proteins, some answers, more questions 1995).
Structure commune
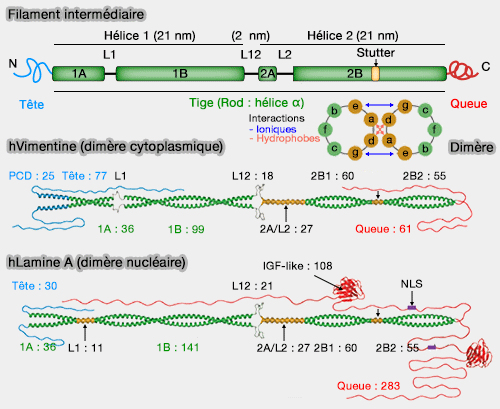
Les filaments intermédiaires sont constitués de différentes protéines fibrillaires (environ 70) de structure de base sensiblement identique (45 nm de long pour 2 de large).
Les filaments intermédiaires présentent une organisation modulaire commune en trois régions structurales distinctes.
Tige centrale
1. La tige centrale (rod domain) est une structure en hélice α, constituée de 4 régions (1a, 1b, 2a, 2b) formées par des répétitions d'heptades, i.e. répétitions de 7 résidus (abcdefg) dans lesquelles a et d sont des résidus hydrophobes (FADLEAK VEEAQRE V).
a. Elle forme des domaines coiled-coil (superhélices), structures protéiques découvertes d'ailleurs dans les kératines en 1952 par Francis Crick (Is alpha-Keratin a Coiled Coil?).
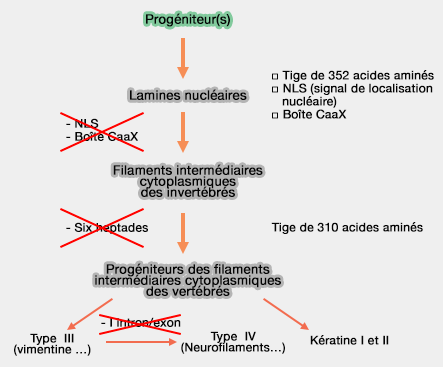
- Les lamines nucléaires (type V) sont formées d'une tige de 352 résidus, comme les autres types d'IF chez les invertébrés.
- Les IF cytoplasmiques des vertébrés perdront 6 heptades (42 résidus), et sont donc constitués de 310 résidus.
b. Trois segments de liaison séparent les 4 régions, i.e. L1 entre 1a et 1b, L12 entre Ib et 2a, et L2 entre 2a et 2b.
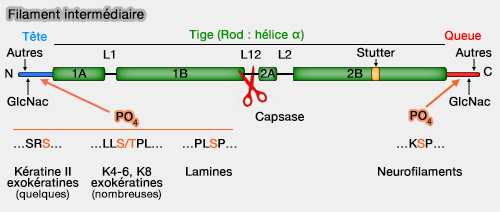
L12 contient un site caspase qui permet le clivage des IF lors de l'apoptose par exemple.
(Figure : vetopsy.fr d'après Herrmann)
2. Trois régions sont particulièrement conservées.
a. Deux régions sont impliquées dans la formation des dimères :
- l'HIP (Helix Initiation Peptide) formé de 26 résidus à l'extrémité proximale de 1a,
- l'HTP (Helix Termination Peptide) formée de 32 résidus à l'extrémité terminale de 2b.
Remarque : ces hélices sont aussi sensibles aux mutations dans de nombreuses maladies génétiques.
b. Quatre résidus supplémentaires (defg) dans la répétition d'heptade appelée " stutter " (bégaiement en français) forment une séquence hydrophile dépliée retrouvée au milieu du segment 2b, à la fin de la 8ème heptade dans la vimentine, dont le rôle, flexion et dépliage ?, doit être précisé (Coiled-coil intermediate filament stutter instability and molecular unfolding 2011)
Tête N-terminale
La tête N-terminale non hélicale varie considérablement en taille et en structure selon les types de filaments, conférant leur spécificité fonctionnelle.
- La nestine ne comporte que 6 résidus contre 167 pour la kératine K5.
- La vimentine comprend un PCD (Pre-Coiled coil Domain).
Queue C-terminale
1. La queue C-terminale est non hélicale et, comme la tête, varie selon les types de filaments.
(Figure : vetopsy.fr d'après Omary)
a. La kératine K19 comporte 15 résidus, contre plus de 1000 résidus pour la nestine.
b. Les lamines nucléaires possèdent en plus :
- un signal de localisation nucléaire (NLS : Nuclear Localization Signal), séquence d'acides aminés qui cible les protéines pour leur transport vers le noyau de la cellule,
- un domaine IGF-like,
- une box CaaX dans certaines isoformes.
2. Les modifications post-traductionnelles (phosphorylation et glycosylation, entre autres) de la tête et de la queue joueraient un rôle important dans le remodelage des filaments intermédiaires.
Assemblage des filaments intermédiaires
Les filaments intermédiaires s'assemblent spontanément et ne nécessitent ni protéines chaperonnes, ni source énergétique, contrairement aux autres constituants du cytosquelette.
Ils peuvent se présenter sous plusieurs formes (Molecular architecture of intermediate filaments 2003 et Intermediate filaments: primary determinants of cell architecture and plasticity 2009).
Assemblage précoce des filaments intermédiaires
Des particules non filamenteuses et de courts filaments, appelés " squiggle " (en français, ligne ondulée), ont été observés pour l’ensemble des types de filaments intermédiaires et le mécanisme précoce d'assemblage serait le suivant.
Ces précurseurs peuvent être produits de novo ou provenir d’un pool cytoplasmique préexistant.
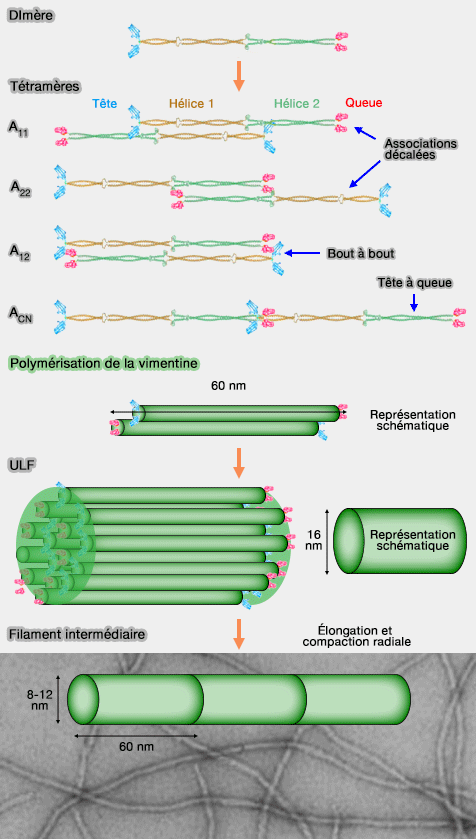
1. Les dimères sont parallèles et dits super-enroulés, grâce aux répétitions d'heptades de la tige centrale.
(Figure : vetopsy.fr d'après Strelkov et Herrmann)
2. Les tétramères antiparallèles constituent l'unité de base des filaments intermédiaires, peuvent être organisés selon plusieurs modes d’association :
a. deux formes d'associations décalées :
- A11 dans laquelle les régions 1b sont approximativement alignées, comme dans la vimentine,
- A22 dans laquelle les régions 2b sont approximativement alignées, comme dans la vimentine par exemple,
b. une forme antiparallèle bout à bout (A22),
c. un alignement longitudinal tête à queue (ACN).
ULF et maturation des filaments intermédiaires
1. L'association latérale de 8 tétramères forme une ULF (Unit-Lenght Filament) correspondant à une unité élémentaire d’assemblage (Near-UV Circular Dichroism Reveals Structural Transitions of Vimentin Subunits during Intermediate Filament Assembly 2009).
Ces unités se connectent tête à queue, en prolongement les unes des autres, pour former une protofibrille de 16 nm de diamètre environ, permettant l’élongation du filament.
2. L’assemblage hiérarchique des filaments intermédiaires est étroitement modulé par des modifications post-traductionnelles, en particulier la phosphorylation (
a. La phosphorylation de résidus sérine de la tête N-terminale module principalement les interactions latérales et la dynamique de remodelage, plutôt que le mécanisme d’allongement lui-même.
- La phosphorylation modifie les interactions électrostatiques entre têtes voisines qui réduisent l’adhérence latérale entre tétramères et ULF, l’assemblage longitudinal tête-à-queue, assuré par la tige coiled-coil, étant peu affecté.
- Le principal effet est une augmentation de la plasticité du réseau par désassemblage local et réorganisation des ULF.
b. La phosphorylation de la queue C-terminale, sans être requise pour l’assemblage initial des filaments intermédiaires, module leur stabilité mécanique et leurs interactions latérales avec les autres composants du cytosquelette.
- Région non hélicale, flexible et exposée, la queue voit sa charge électrostatique et sa conformation locale modifiées par phosphorylation (Role of Phosphorylation on the Structural Dynamics and Function of Types III and IV Intermediate Filaments 2008).
- Les protéines adaptatrices comme les plakines (plectine, BPAG1/dystonine) possèdent plusieurs domaines de liaison leur permettant d’interagir simultanément avec les filaments intermédiaires, les microfilaments d’actine et les microtubules.
3. Les filaments intermédiaires matures résultent d’une compaction radiale qui réduit leur diamètre final de 16 nm à environ 8–11 nm.
La compaction radiale correspond à une étape tardive de l’assemblage des filaments intermédiaires, au cours de laquelle l’organisation interne du filament se réarrange sans ajout ni perte de sous-unités.
- Les tiges centrales coiled-coil se réalignent et s’empaquettent plus étroitement.
- Les domaines N- et C-terminaux non hélicaux sont progressivement repoussés vers la périphérie.
- Cette réorganisation interne s’accompagne d’une diminution de l’hydratation et de l’espace intermoléculaire au sein du filament, conduisant à un filament plus dense et mécaniquement résistant.
Remarque : la définition des termes protofibrilles et protofilaments diffère selon les auteurs et les types d'IF et peut désigner les tétramères, leur association…
4. Selon le type de filament intermédiaire, le modèle général d’assemblage peut être partiellement modifié.
- Pour les cytokératines, les dimères sont obligatoirement hétérodimériques, i.e. association d’une kératine de type I et d’une kératine de type II, alors que les autres types de filaments intermédiaires forment majoritairement des homodimères.
- Les lamines (type V) s’assemblent préférentiellement par polymérisation longitudinale tête à queue (
assemblage des lamines).

Les lamines sont étudiées dans des chapitres spécifiques.
En outre, selon les conditions, le nombre de tétramères peut varier : ce processus semble être important pour le remodelage du réseau.
- Le nombre de tétramères constituant une ULF peut varier selon les conditions cellulaires et semble jouer un rôle important dans le remodelage du réseau, 6-10 dans les kératines par exemple,
- Pour la vimentine, le nombre standard est de 8 tétramères (32 monomères), mais des assemblages contenant 48 monomères in vivo, voire jusqu’à 84 monomères in vitro, ont été décrits.
Remodelage du réseau de filaments intermédiaires
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesIFAPLaminesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


