Reproduction : spermatogenèse
Cellules de Leydig et régulation hormonale
- Reproduction
- Anatomie du système génital
- Physiologie de la reproduction
- Gestation
- Parturition (mise bas)
- Lactation
Le testicule produit de nombreuses hormones dont les principales sont les androgènes, et en particulier la testostérone.

D'autres molécules sont présentes dans ces cellules et ont des rôles variés.
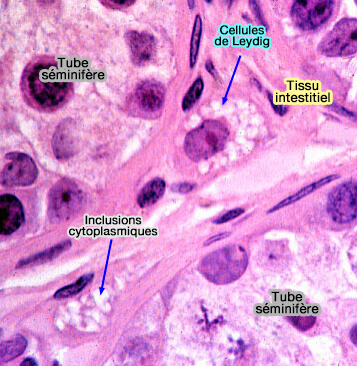
Cellules de Leydig
1. Les cellules de Leydig sont des cellules polygonales groupées en amas dans l'espace interstitiel, qui renferme de nombreuses fibres de collagène, séparant les tubes séminifères.
- Les cellules de Leydig ont été découvertes par Franz von Leydig en 1850.
- Elles se trouvent à proximité de capillaires sanguins, d'espaces lymphatiques et d'autres cellules.
Le noyau est rond et le cytoplasme comprend de nombreux organites et des enclaves lipidiques en grand nombre.
Chez l'homme, on observe des cristalloïdes de Reinke dont le rôle est encore inconnu. Chez les animaux à reproduction saisonnière, elles se dédifférencient pendant les périodes de repos sexuel.
2. Les cellules de Leydig produisent de nombreuses molécules.:

Les cellules de Leydig sécrètent essentiellement des androgènes : 95% ou plus de la testostérone est d'origine testiculaire.
(Photo : histology learning system)
Elles produisent d'autres molécules :
- de l'ocytocine et de la vasopressine (ADH) pour contracter les cellules myoïdes des tubes séminifères pour augmenter leur motilité ;
- de l'IGF-1, sécrété également par les cellules de Sertoli, qui augmente le nombre des récepteurs à la LH (Luteinizing Hormone, hormone lutéinisante) et active des enzymes intervenant dans la stéroïdogenèse ;
- des oestrogènes, estrone (E1) et estriol (E3).

Les cellules de Leydig sont l'équivalent des cellules de la thèque interne du follicule ovarien.
Stéroïdes testiculaires
1. La testostérone est synthétisée par les cellules du tissu interstitiel ou cellules de Leydig (cf. plus haut) à partir du cholestérol (stéroïdogenèse).
- La testostérone est l'hormone de différenciation gonadique et des voies génitales (développement des organes sexuels pendant l'embryogenèse), aussi bien internes (en synergie avec l'AMH ou hormone anti-mullerienne) qu'externes.
- Lors de la puberté, son taux s'élève et déclenche le début de la spermatogenèse.
2. Si on bloque les androgènes, la spermatogenèse s'arrête au stade leptotène de la méiose et le mâle ne produit aucun spermatozoïde (mâle aspermatogénique). Si on restimule la stéroïdogenèse, la spermatogenèse et restaurée.
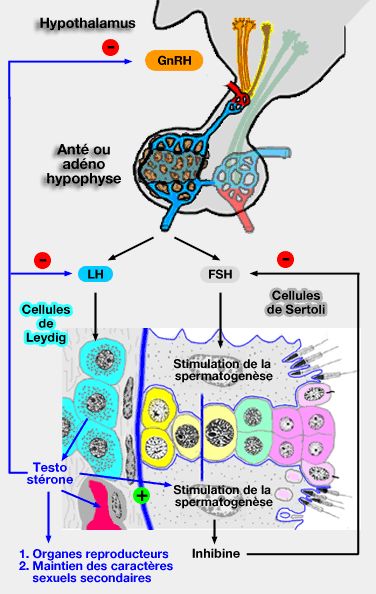
Niveau hypophysaire et hypothalamique
1. La sécrétion des androgènes par les cellules de Leydig est initiée en réponse à la sécrétion de la LH (Luteinizing Hormone, hormone lutéinisante), grâce à leurs récepteurs membranaires.
La testostérone est libérée sous forme de pulses, c'est-à-dire de petits épisodes brefs (sécrétion pulsatile).
- Chez l'homme, la stabilité du rythme des pulses maintient une constance de la testostéronémie (4 à 8 ng/ml), contrairement aux variations cycliques des stéroïdes sexuels chez la femme.
- La prolactine, l'hormone de croissance, l'insuline et l'inhibine favoriseraient l'action de la LH, sans être capables, seules, de stimuler la stéroïdogenèse.
(Figure : vetopsy.fr)
2. La FSH (Follicle Stimulating Hormone ou hormone folliculo-stimulante) a un rôle favorisant de la spermatogenèse.
La FSH se lie aux récepteurs de la cellule de Sertoli pour stimuler l'action de nombreuses protéines (dont l'androgen binding protein ou ABP et l'inhibine), la production énergétique, la production du liquide testiculaire…
- La FSH stimule également la formation des récepteurs aux androgènes pour rendre la cellule de Sertoli plus sensible à la testostérone (qui stimulera, à son tour, les récepteurs à la FSH), ce qui permet une augmentation de la spermatogenèse.
- Par contre, si la spermatogenèse est trop active les cellules de Sertoli sécrètent de l'inhibine qui exerce une rétro-inhibition sur l'hypothalamus et l'adénohypophyse, ce qui diminue l'ABP, en particulier, et produit un ralentissement de la spermatogenèse.
Par contre, chez l'homme, les niveaux sérologiques d'inhibine B évaluent assez bien la fonction testiculaire, et en particulier, le fonctionnement des cellules de Sertoli. Les concentrations sont réduites dans bon nombre d'in fertilités, bien plus que les concentrations de FSH ou de LH.
Niveau local
1. La testostérone passe rapidement :
- dans le liquide interstitiel qui entoure les cellules de Leydig,
- dans le sang,
- dans la lymphe où elle se retrouve au contact avec les canaux efférents et des glandes (en particulier, prostate ou glandes bulbo-urétrales) qui subissent une stimulation,
- dans les tubes séminifères, au travers des barrières cellulaires (grâce à sa liposolubilité).
2. Dans les tubes séminifères, la testostérone est transformée en dihydrotestostérone (DHT), forme active de la testostérone dans les cellules sensibles aux androgènes, grâce à la 5α-réductase des cellules de Sertoli. Cette dihydrotestostérone se lie alors :
- avec un récepteur aux androgènes des cellules de Sertoli,
- avec l'androgen-binding protein (ABP).
L'androgen-binding protein (ABP) est une beta-globuline sécrétée par les cellules de Sertoli activées par la FSH, au niveau du comportement juxta-luminal.
- Grâce à cette liaison, la dihydrotestostérone devient moins lipophile et permet alors le transport dans le liquide testiculaire pour stimuler les tubules.
- Ce phénomène explique les très fortes concentrations tubulaires de testostérone qui stimulent la spermatogenèse et la maturation des spermatozoïdes dans l'épididyme.
(Figure : Boghogtalk | contribs)
L'ABP peut se lier à la testostérone, la dihydrotestostérone (DHT) et l'estradiol. La DHT peut être également aromatisée en oestrogènes (estradiol et estrone) en quantité variable selon les espèces.

Chez les reproducteurs dits saisonniers, la spermatogenèse varie en fonction des saisons et de la capacité des cellules de Sertoli à fixer les androgènes et à produire la dihydrotestostérone, grâce à la 5α-réductase.
3. Le niveau local module l'activité de la synthèse de la testostérone par une communication paracrine et autocrine, aussi bien :
- au niveau testiculaire, par la collaboration étroite entre les cellules de Sertoli et les cellules de Leydig ;
- au niveau hypophysairepar un rétro-contrôle sur l'hypophyse (sur LH, plus que sur FSH) et sur l'hypothalamus (sur GnRH) par une multitude de neurotransmetteurs ;
- au niveau vasculaire par l'action vasoconstrictrice de la noradrénaline qui stimule la stéroïdogenèse (récepteurs β-adrénegiques sur les cellules de Leydig et de Sertoli).
Des récepteurs à la vitamine A sont aussi détectés au niveau des cellules de Sertoli (ce qui explique l'infertilité dans son avitaminose), mais son mécanisme est inconnu.
Autres molécules
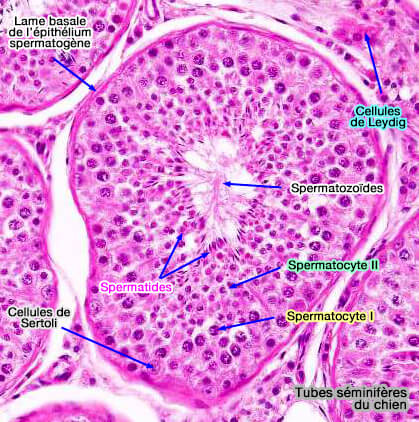
Les cellules de Sertoli produisent de nombreuses molécules qui régulent la spermatogenèse.
1. Les inhibines et les activines passent dans le liquide séminifère et sont réabsorbées au niveau épididymaire.
(Photo : uogelph.ca)
Elles passent dans le sang pour agir sur l'adénohypophyse et ont également un rôle paracrine et autocrine :
- les inhibines positivement sur les cellules de Leydig et négativement sur les cellules de la lignée germinale,
- les activines négativement sur les cellules de Leydig et positivement sur celles de la lignée germinale.
2. Les facteurs de croissance régulent également le développement des cellules de la lignée germinale et les cellules de Leydig.
- L'IGF-1 (Insulin-like growth factor I) accroît et le TGF-beta (Transforming growth factor beta) dilminue la production des cellules germinales grâce à des récepteurs membranaires.
- Le RLF (Relaxin Like-Factor), qui fait partie des insulin-like growth factor, est présent en grande quantité dans les cellules de Leydig : son rôle est mal connu.
- Des récepteurs à la transferrine semblent réguler la croissance des cellules et la phagocytose des corps résiduels des spermatides.
ReproductionAnatomie du système génitalReproduction du chienReproduction du chatPhysiologie de la reproductionMise en place (période embryonnaire)PubertéGamétogenèseMéioseSpermatogenèseSpermiogenèseSpermatozoïdesOrganisation spatio-temporelleCellules de Sertoli et régulationCellules de Leydig et régulationSpermeOvogenèseCycles oestrauxCoït ou copulationFécondationGestationDéveloppement des annexesDéveloppement de l'embryonParturitionLactation


